Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Окисление аммиака — степень, валентность и свойства соединения
Одно из наиболее значимых азотосодержащих соединений — аммиак, степень окисления азота в котором равна -3. Это бесцветный газ, гораздо легче воздуха, с едким прикусом, обладающий резким, неприятным запахом: нашатырный спирт, который используют медики для того, чтобы привести в чувство человека — водный раствор гидроксида аммония, щелочи, полученной от растворения газообразного Nh4 в воде.
Содержание
- Получение и основные свойства
- Химические характеристики
- Применение соединения
Получение и основные свойства
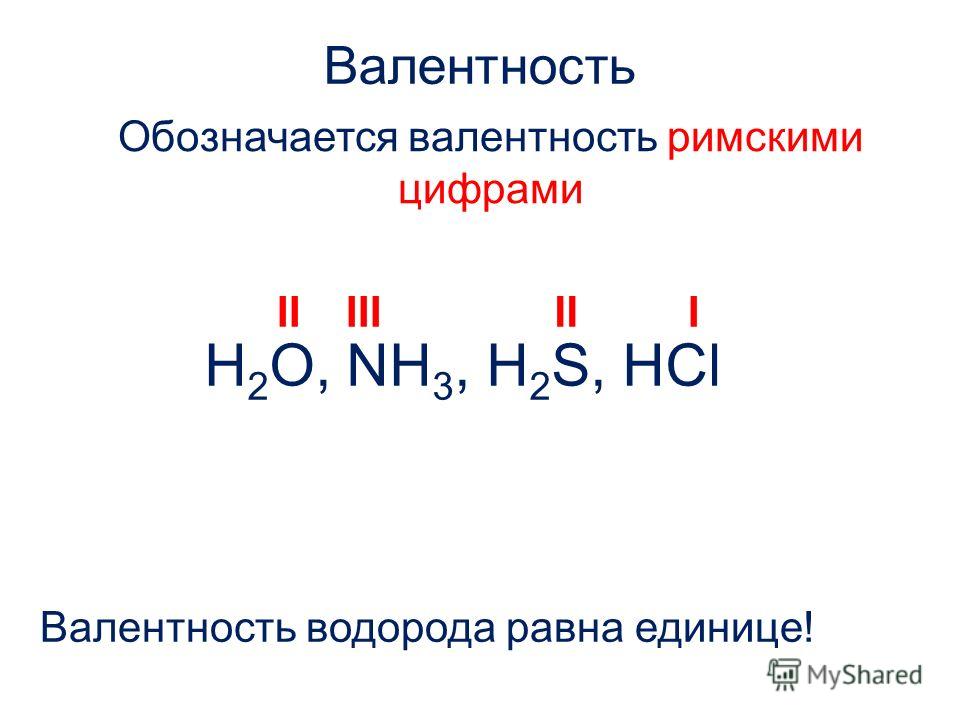
Аммиак — бинарное соединение (вещество, состоящее из двух элементов), в состав которого входят атомы водорода и азота с валентностью III. Молекула по форме напоминает пирамиду: в основании лежит треугольник из водородных атомов, а на вершине — азот. Каждая из трех связей — ковалентная полярная. Основные характеристики:
Молекула по форме напоминает пирамиду: в основании лежит треугольник из водородных атомов, а на вершине — азот. Каждая из трех связей — ковалентная полярная. Основные характеристики:
- Nh4 сжижается при -33,35 °C (при высоком давлении сжижается уже при комнатной температуре).
- При -77,7 °C затвердевает.
Получают аммиак несколькими способами. Например, в лабораториях его синтезируют путем взаимодействия солей аммония со щелочами:
- Nh5Cl + NaOH → NaCl + Nh4 + h3O;
- 2Nh5Cl + Ca (OH)2 → CaCl2 + Nh4 + h3O.
- Nh5HCO3 (гидрокарбонат аммония) → Nh4 + CO2 + h3O.
Это каталитические реакции, которые возможны только при нагревании. Здесь степень окисления Nh4, а точнее, катиона Nh5, во всех соединениях равна +1. Результатом процесса становится образование газообразного аммиака, а также хлорида и воды. Другие способы:
- Термическое разложение гидроксиламина (Nh3OH — соединение азота валентностью III) — Nh3OH → Nh4 + N2 + 3h3O.
 Реакция протекает при 100 °C.
Реакция протекает при 100 °C. - Гидролиз нитридов — Ca3N2 + 6h3O → 2 Nh4 + 3Ca (OH)2, то есть в результате образуется газообразный аммиак плюс гашеная известь, которая выпадает в осадок.
В промышленности аммиак получают синтезом азота и водорода: N2 + 3h3 → 2Nh4. Эта реакция протекает при t=500−550°C, повышенном давлении и в присутствии катализатора, в роли которого используется железо с добавками оксидов алюминия и калия.
Кроме того, это соединение образуется и при коксовании углей (как побочный продукт).
В природе аммиак образуется при разложении азотсодержащих органических веществ. Некоторые количества этого газа можно обнаружить в дождевой воде и в воздухе. Соединение считается малоопасным. Однако превышение его концентрации в водоемах приведет к массовой гибели его обитателей. Именно по этой причине аквариумисты так тщательно следят за тем, чтобы содержание вещества в воде всегда оставалось в норме (определить содержание Nh4 можно только с применением специального набора для проверки).
Химические характеристики
Аммиак хорошо растворяется в воде, спиртах, ацетоне, бензоле. Водный раствор Nh4 называют аммиачной водой, или нашатырным спиртом. При получении этого вещества происходит реакция термической диссоциации: Nh4 + h3O → Nh5OH.
Однако последующее нагревание снизит реакционную способность этого газа, и он попросту улетучится.
Аммиак хорошо горит в атмосфере кислорода, хуже — на воздухе, образуя при этом (без катализатора) азот и воду, а при использовании платины в качестве ускорителя процесса — монооксид азота и h3O:
- 4Nh4 + 3O2 → 2N2 + 6h3O;
- 4Nh4 + 5O2 → 4NO + 6h3O.
При высокой температуре аммиак может взаимодействовать с металлами. В результате образуются нитриды и свободный водород: 2AL + 2Nh4 → 2ALN + 3h3.
Гидроксид аммония обладает всеми свойствами оснований. Он вступает в реакцию с кислотами и кислотными оксидами:
Он вступает в реакцию с кислотами и кислотными оксидами:
- Nh5OH + h3SO4 → Nh5HSO4 + h3O.
- Nh5OH + Nh5HSO4 → (Nh5)2SO4 + h3O.
- Nh5OH + CO2 → (Nh5)2CO3 + h3O.
Аммиак легко вступает в реакции с кислотами, образуя при этом аммонийные соли: Nh4 + HCl → Nh5CL. При нагревании они (за исключением Nh5NO2 и Nh5NO3) разлагаются на аммиак и кислоту, которые, охлаждаясь, образуют исходную соль
Взаимодействие с азотной кислотой дает в результате нитрат аммония: Nh4 + HNO3 → Nh5NO3. Степень окисления азота в этом соединении равна +5. Полученное вещество — аммонийная селитра — используется как азотное удобрение, и в качестве компонента взрывчатки.
Применение соединения
Аммиак — одно из важнейших азотных соединений. Ежегодно его производят в огромных количествах — более 100 млн тонн. Основная часть произведенного вещества идет на нужды химической промышленности. Что получают с использованием Nh4:
Что получают с использованием Nh4:
- Удобрения.
- Кальцинированную соду — аммиак используется для насыщения солевого раствора.
- Синтез азотной кислоты — в процессе получения требуется аммиак (синтетический).
- Производство нитрата аммония (взрывчатка) — это соединение ведет себя нейтрально при механических воздействиях, однако при определенных условиях оно характеризуется высокими взрывчатыми свойствами.
- Изготовление растворителей, способных реагировать со многими органическими и неорганическими веществами.
- Хладагенты — те, что изготавливают на основе аммиака, наносят меньший вред экологии, чем «привычные» фреоны. Кроме того, аммиачные охлаждающие агенты по стоимости ниже, чем их холодильные «сородичи».
- При производстве средств бытовой химии — например, стеклоочистители, содержащие аммоний, выполняют свою «задачу» гораздо быстрее и качественнее.
- Для производства пятновыводителей (аммиачная вода отлично справляется с различными загрязнениями одежды).

Используется аммиак и в фармацевтической отрасли — для изготовления нашатырного спирта. Это соединение применяется не только как средство для устранения обмороков, но и в качестве рвотного препарата (это незаменимо при отравлениях, особенно алкогольных). Из нашатыря делают различные примочки, им обрабатывают места укуса насекомых.
А хирурги обеззараживают нашатырным раствором свои руки перед операциями.
Предыдущая
ХимияГидриды — свойства, формулы и применение водородных соединений
Следующая
ХимияПолучение кислорода в промышленности — основные способы и технология производства
Химический состав
Химические свойства
Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к
диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т.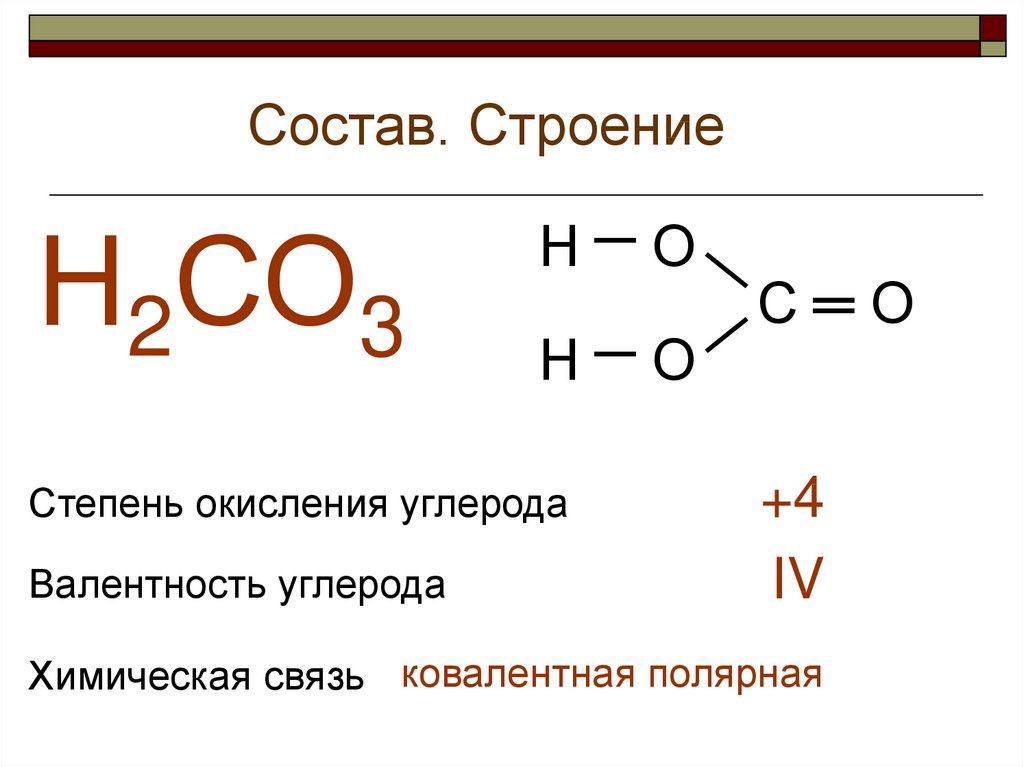 п.) или
комплексах (например, [Cu(Nh4)2]+). Её соединения бесцветны. Более устойчива степень окисления +2,
которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со
степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23−,
полученных в 1994 году.
п.) или
комплексах (например, [Cu(Nh4)2]+). Её соединения бесцветны. Более устойчива степень окисления +2,
которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со
степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23−,
полученных в 1994 году.
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Переводится враствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
2Cu + h3O + CO2 + O2 à Cu2CO3(OH)2↓
Реагирует с концентрированной холодной серной кислотой:
Cu + h3SO1 àCuO + SO2 ↑ + h3O
С концентрированной горячей серной кислотой:
Cu + 2h3SO4 à CuSO4 + SO2 ↑ + 2h3O
- В электротехнике
- Теплообмен
- Для производства труб
- Сплавы
- Сплавы на основе меди
- Сплавы, в которых медь значима
- Ювелирные сплавы
- Соединения меди
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C:
0,01724-0,0180 мкОм·м), медь широко применяется в электротехнике для изготовления силовых и других
кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою
очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых
трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую
проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость
почти на 10 %.
Медные провода, в свою
очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых
трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую
проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость
почти на 10 %.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известныерадиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные
трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во
внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и
холодильных агрегатах.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко
распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими
названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель,
висмут и другие металлы.

 Медь
является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов
Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения
разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до
жидкостных ракетных двигателей.
Медь
является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов
Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения
разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до
жидкостных ракетных двигателей.Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой
для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных
гальванических элементов и батарей.
Влияние степени окисления Mn и кислорода решетки в катализаторах TiO2 на основе Mn на низкотемпературное селективное каталитическое восстановление NO Nh4
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый будний день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2012 сен; 62 (9): 1085-92.
дои: 10.1080/10962247.2012. 696532.
696532.
Санг Мун Ли 1 , Кван Хи Пак, Сон Су Ким, Дон Вук Квон, Сунг Чан Хон
принадлежность
- 1 Факультет инженерии экологических энергетических систем, Университет Кёнги, 94 Сан, Иуи-дон, Ёнтон-ку, Сувон-си, Кёнгидо 442-760, Южная Корея.
- PMID: 23019822
- DOI: 10.1080/10962247.2012.696532
Санг Мун Ли и др. J Air Waste Manag Assoc. 2012 9 сентября0005
. 2012 сен; 62 (9): 1085-92.
дои: 10. 1080/10962247.2012.696532.
1080/10962247.2012.696532.
Авторы
Санг Мун Ли 1 , Кван Хи Пак, Сон Су Ким, Дон Ук Квон, Сон Чан Хон
принадлежность
- 1 Факультет инженерии экологических энергетических систем, Университет Кёнги, 94 Сан, Иуи-дон, Ёнтон-ку, Сувон-си, Кёнгидо 442-760, Южная Корея.
- PMID: 23019822
- DOI: 10.1080/10962247.2012.696532
Абстрактный
Катализаторы оксида марганца на носителе TiO2, сформированные с использованием различных температур прокаливания, были приготовлены с использованием метода влажной пропитки и исследованы на их активность в низкотемпературном селективном каталитическом восстановлении (СКВ) NO с помощью Nh4 в отношении валентности Mn и кислорода решетки. поведение. Поверхностные и объемные свойства этих катализаторов исследовали с использованием площади поверхности Брунауэра-Эммета-Теллера (БЭТ), дифракции рентгеновских лучей (РД), температурно-программируемого восстановления (ТПВ) и температурно-программируемой десорбции (ТПД). Катализаторы, полученные при более низких температурах прокаливания, содержащие Mn4+, проявляли высокую активность СКВ при низких температурах, имели несколько кислотных центров и активный кислород. ТПД-анализ показал, что кислотные центры Бренстеда и Льюиса в катализаторах Mn/TiO2 важны для низкотемпературной СКВ при 80–160 и 200–350°C соответственно. Кроме того, доступный кислород решетки был важен для достижения высокой степени окисления NO в NO2 при низких температурах.
поведение. Поверхностные и объемные свойства этих катализаторов исследовали с использованием площади поверхности Брунауэра-Эммета-Теллера (БЭТ), дифракции рентгеновских лучей (РД), температурно-программируемого восстановления (ТПВ) и температурно-программируемой десорбции (ТПД). Катализаторы, полученные при более низких температурах прокаливания, содержащие Mn4+, проявляли высокую активность СКВ при низких температурах, имели несколько кислотных центров и активный кислород. ТПД-анализ показал, что кислотные центры Бренстеда и Льюиса в катализаторах Mn/TiO2 важны для низкотемпературной СКВ при 80–160 и 200–350°C соответственно. Кроме того, доступный кислород решетки был важен для достижения высокой степени окисления NO в NO2 при низких температурах.
Подразумеваемое: Недавно различные катализаторы Mn были оценены как катализаторы SCR. Однако исследования взаимосвязи адсорбционно-десорбционных свойств и поведения решеточного кислорода в зависимости от валентного состояния для оксидов марганца (MnO(x)) не проводились. Поэтому в данном исследовании катализаторы готовили методом влажной пропитки при разных температурах прокаливания, чтобы показать разницу в степени окисления марганца. Затем эти катализаторы были охарактеризованы с использованием различных физико-химических методов, включая BET, XRD, TPR и TPD, чтобы понять структуру, степень окисления, окислительно-восстановительные свойства, а также адсорбционные и десорбционные свойства катализаторов Mn/TiO2.
Поэтому в данном исследовании катализаторы готовили методом влажной пропитки при разных температурах прокаливания, чтобы показать разницу в степени окисления марганца. Затем эти катализаторы были охарактеризованы с использованием различных физико-химических методов, включая BET, XRD, TPR и TPD, чтобы понять структуру, степень окисления, окислительно-восстановительные свойства, а также адсорбционные и десорбционные свойства катализаторов Mn/TiO2.
Похожие статьи
Легированный железом катализатор Mn-Ce/TiO2 для низкотемпературного селективного каталитического восстановления NO с помощью Nh4.
Шэнь Б., Лю Т., Чжао Н., Ян С., Дэн Л. Шен Б. и др. J Environ Sci (Китай). 2010;22(9):1447-54. doi: 10.1016/s1001-0742(09)60274-6. J Environ Sci (Китай). 2010. PMID: 21174978
Влияние прекурсоров марганца на катализаторы на основе Mn/TiO2 для каталитического восстановления NO с помощью Nh4.

Тонг Х, Хуан Ю. Тонг Х и др. J Air Waste Manag Assoc. 2012 март; 62(3):271-7. дои: 10.1080/10473289.2011.646350. J Air Waste Manag Assoc. 2012. PMID: 22482285
Сравнительное исследование катализаторов Mn/TiO 2 -M(M = Sn, Zr или Al) O x для NH 3 — Реакция СКВ при низкой температуре.
Чжан И, Хуан Т, Сяо Р, Сюй Х, Шен К, Чжоу С. Чжан И и др. Экологические технологии. 2018 Май; 39(10):1284-1294. дои: 10.1080/21622515.2017.1329345. Эпаб 2017 29 мая. Экологические технологии. 2018. PMID: 28504006
Экологически безопасные катализаторы селективного каталитического восстановления NO(x) в дизельных двигателях: взаимосвязь структура-активность и аспекты механизма реакции.

Лю Ф, Ю Ю, Хе Х. Лю Ф и др. Химическая коммуна (Кэмб). 2014 11 августа; 50 (62): 8445-63. дои: 10.1039/c4cc01098a. Химическая коммуна (Кэмб). 2014. PMID: 24819654 Обзор.
Каталитическое удаление толуола на катализаторах на основе оксида марганца: обзор.
Лю Ю, Ли С, Ду Х, Чжу Ю, Чжан Ю, Ли С. Лю Ю и др. Environ Sci Pollut Res Int. 2020 янв; 27 (3): 2482-2501. дои: 10.1007/s11356-019-07037-2. Epub 2019 17 декабря. Environ Sci Pollut Res Int. 2020. PMID: 31848947 Обзор.
Посмотреть все похожие статьи
Цитируется
Влияние исходного размера частиц носителя на катализаторы MnO x /TiO 2 на селективное каталитическое восстановление NO NH 3 .

Yang Y, Hu Z, Mi R, Li D, Yong X, Yang H, Liu K. Ян Ю и др. RSC Adv. 20196 февраля; 9 (9): 4682-4692. дои: 10.1039/c8ra10077b. Электронная коллекция 2019 5 февраля. RSC Adv. 2019. PMID: 35514617 Бесплатная статья ЧВК.
Сетевой фармакологический анализ полезных эффектов Pogostemon cablin (Blanco) Benth для облегчения неалкогольной жировой болезни печени у мышей.
Цуй Ю, Ван Кью, Чанг Р, Аборага А, Лоор Дж.Дж., Сюй К. Цуй Ю и др. Фронт Фармакол. 2021 ноя 24;12:789430. doi: 10.3389/fphar.2021.789430. Электронная коллекция 2021. Фронт Фармакол. 2021. PMID: 34899351 Бесплатная статья ЧВК.
Влияние температуры прокаливания на эффективность активации и механизм реакции Ce-Mn-Ru/TiO 2 Катализаторы для селективного каталитического восстановления NO NH 3 .

Рен З., Чжан Х., Ван Г., Пан Ю., Ю З., Лонг Х. Рен З. и др. АСУ Омега. 2020 16 декабря; 5(51):33357-33371. дои: 10.1021/acsomega.0c05194. Электронная коллекция 2020, 29 декабря. АСУ Омега. 2020. PMID: 33403298 Бесплатная статья ЧВК.
Типы публикаций
термины MeSH
вещества
Процитируйте
Формат: ААД АПА МДА НЛМ
Отправить на
Спрос и предложение| Международный журнал по водным видам спорта
Положительные и отрицательные стороныВот взгляд на некоторые распространенные загрязнители рекреационной воды и их реакцию на хлорноватистую кислоту на основе их степени окисления. Помните, что HOCL имеет степень окисления +1, а хлор имеет степень окисления -1.
Помните, что HOCL имеет степень окисления +1, а хлор имеет степень окисления -1.Потребность в хлоре можно определить как неспособность поддерживать остаточное количество хлора. Почти бесконечное количество веществ может способствовать спросу. К ним относятся бактерии, водоросли, аммиак, моча, пот, товары для здоровья и красоты, отходы купания и отходы животных. Такие загрязняющие вещества могут попадать в воду различными путями — через воду источника, дождевую воду, купающихся, животных, удобрения, растения/листья и промышленные загрязнения. Таким образом, определение причины потребности в хлоре в том или ином бассейне иногда может показаться непреодолимой задачей.
Хлорноватистая кислота, или свободный доступный хлор, может быть отличным инструментом в решении проблем спроса на хлор. Это связано с тем, что хлорноватистая кислота легко вступает в реакцию со многими различными типами материалов. Глядя на химическую структуру некоторых загрязняющих веществ, можно предсказать, будет ли взаимодействие с хлорноватистой кислотой, что определит, способствует ли это конкретное загрязняющее вещество спросу.
Все атомы имеют так называемую предпочтительную «степень окисления» или «степень окисления». Это просто номер, который присваивается конкретному атому на основе его химических свойств. Например, предпочтительная степень окисления для хлора равна -1. Предпочтительная степень окисления азота и фосфора равна +5. Атомы в непредпочтительной степени окисления очень реакционноспособны, в то время как атомы в предпочитаемой ими степени окисления стабильны и гораздо менее реакционноспособны. Не важно знать, как определяются степени окисления, но знать, что они из себя представляют, очень полезно.
В хлорноватистой кислоте (HOCl) хлор фактически имеет степень окисления +1, что не является предпочтительным. Поскольку хлор постоянно пытается достичь своего предпочтительного состояния -1, хлорноватистая кислота очень реактивна. Вот почему это такой отличный окислитель. Когда хлорноватистая кислота окисляет другие материалы, атом хлора оказывается там, где он хочет быть, при -1.
В молекуле аммиака (Nh4) атом азота имеет степень окисления -3. Как упоминалось ранее, он предпочитает +5. Это также делает его очень реактивным. Поскольку хлор в хлорноватистой кислоте нуждается в уменьшении степени окисления (от +1 до -1), а азот в аммиаке нуждается в увеличении степени окисления (от -3 до +5), эти химические вещества идеально реагируют друг с другом. .
Аммиак удаляется из воды бассейна путем применения хлорирующих продуктов, и при этом расходуется хлорноватистая кислота. Аналогичный процесс происходит с загрязнителями отходов купания, такими как мочевина и креатинин. Однако процесс окисления этих соединений намного дольше, потому что они более сложные.
Так же, как некоторые соединения легко реагируют с хлорноватистой кислотой, некоторые соединения не склонны реагировать с ней. Например, азот в нитратах (NO3-) уже находится там, где он должен быть при +5. То же самое верно и для атома фосфора в фосфате (PO4-3). В молекуле ортофосфата атом фосфора также находится там, где он хочет быть при +5. Это делает их довольно стабильными и маловероятными для реакции с хлорноватистой кислотой. Если материал не вступает в реакцию с хлорноватистой кислотой, то он не способствует потребности в хлоре. Если бы фосфат или нитрат реагировали с хлором, то эти соединения удалялись бы при шокировании бассейна, но этого не происходит.
Это делает их довольно стабильными и маловероятными для реакции с хлорноватистой кислотой. Если материал не вступает в реакцию с хлорноватистой кислотой, то он не способствует потребности в хлоре. Если бы фосфат или нитрат реагировали с хлором, то эти соединения удалялись бы при шокировании бассейна, но этого не происходит.
К сожалению, не существует простого решения многих ситуаций, связанных с потребностью в хлоре. В большинстве случаев остается только два варианта.
Во-первых, применить соответствующее количество продукта хлорирования; во-вторых, заменить часть воды пресной водой, не требующей хлора.
В ситуациях, когда потребность в хлоре сопровождается очень мутной водой, обработка флокулянтом может снизить потребность путем физического удаления некоторых загрязнителей из воды. Имейте в виду, что обработка хлопьями или замена воды не устраняют потребность полностью, а только уменьшают ее. Необходимо будет провести повторное тестирование и применить новое рекомендуемое количество хлорирующего продукта.
Удовлетворение потребности в хлоре может показаться чрезмерным, особенно если потребность велика. Во время обработки важно понимать, что существуют две категории загрязняющих веществ, подлежащих обработке. Первый — «быстродействующий», который включает небольшие молекулы, такие как аммиак. Второй тип — «медленно реагирующий», который включает в себя более крупные молекулы, такие как аминокислоты и белки. Как правило, более сложные, чем более мелкие молекулы, им требуется больше времени для окисления. Эти более крупные, медленно реагирующие загрязняющие вещества обычно являются результатом отходов жизнедеятельности пловцов, таких как пот или моча, и для их полного окисления может потребоваться до 36 часов. Потребность в хлоре, вероятно, вызвана сочетанием различных типов загрязняющих веществ, поэтому время и сложность обработки могут варьироваться.
Конечно, лучший способ действий — это всегда профилактика. Регулярное окисление, а также применение поддерживающего альгицида помогут сохранить воду чистой и свободной от загрязняющих веществ, которые могут способствовать потребности в хлоре. Также важно знать, когда требуется дополнительное окисление. Это включает в себя большое количество купающихся, дождь, более высокие, чем обычно, температуры и любое время, когда есть подозрение на загрязнение воды в бассейне. Разработка программы технического обслуживания с учетом характеристик каждого объекта поможет предотвратить проблемы до их возникновения.
Также важно знать, когда требуется дополнительное окисление. Это включает в себя большое количество купающихся, дождь, более высокие, чем обычно, температуры и любое время, когда есть подозрение на загрязнение воды в бассейне. Разработка программы технического обслуживания с учетом характеристик каждого объекта поможет предотвратить проблемы до их возникновения.
Видео-урок: Цифры окисления | Nagwa
Стенограмма видео
В этом видео мы узнаем о степенях окисления, что они собой представляют, как их рассчитать и как использовать их для идентификации окислительно-восстановительных реакций.
Электроны в химии довольно сложно уследить. У нас есть хорошее понимание ионной связи, когда анионы и катионы притягиваются друг к другу, и у нас есть понимание ковалентной связи, когда общие электроны находятся между атомами, связывая их вместе. Однако комплексные ионы обычно также содержат ковалентные связи, например, нитрат-анион. И также часто бывает, что типы связи могут меняться из-за реакции. Достаточно легко отслеживать электроны, когда мы имеем дело с чисто ионной или чисто ковалентной связью. Но что, если у нас есть смесь? Было бы полезно иметь простую систему, которая будет отслеживать электроны при любых обстоятельствах.
Достаточно легко отслеживать электроны, когда мы имеем дело с чисто ионной или чисто ковалентной связью. Но что, если у нас есть смесь? Было бы полезно иметь простую систему, которая будет отслеживать электроны при любых обстоятельствах.
Это атом углерода. Атом углерода может реагировать с атомом кислорода с образованием молекулы монооксида углерода. Это явно реакция окисления, поскольку мы добавляем кислород к углероду. А монооксид углерода может подвергаться дальнейшему окислению с образованием диоксида углерода. Но из этого неясно, какие атомы имеют больше электронов, чем обычно, а какие меньше. Для этого химики изобрели систему учета, которая работает и для ковалентной связи, и для ионной связи. Эта система основана на эффективном положении электронов в ковалентных связях. Если электроны находятся ближе к одному атому, чем к другому, атом, к которому они ближе всего, считается восстановленным, а атом, от которого они находятся дальше, считается окисленным.
Мы можем запомнить эту связь, используя мнемонику «НЕФТЬ». Окисление — это потеря электронов, а восстановление — их приобретение. Если электроны в ковалентной связи ближе к одному атому, мы можем считать, что этот атом получил электроны и, следовательно, восстановился.
Окисление — это потеря электронов, а восстановление — их приобретение. Если электроны в ковалентной связи ближе к одному атому, мы можем считать, что этот атом получил электроны и, следовательно, восстановился.
Мы можем использовать электроотрицательность атомов элементов в ковалентной связи, чтобы предсказать, к какому атому электроны, вероятно, будут ближе всего. Электроотрицательность углерода значительно ниже электроотрицательности кислорода. Это означает, что мы ожидаем, что электроны в углеродно-кислородных связях, например, в монооксиде углерода и диоксиде углерода, будут ближе к атомам кислорода. В этой системе учета, которую придумали химики, мы представляем, что атом, к которому ближе всего электроны, фактически получает эти электроны. Итак, вместо атомов мы представляем себе анионы и катионы.
Используя этот метод, мы можем определить, что углерод в этих реакциях переходит от нейтрального атома к эффективному иону с двумя плюсами и к эффективному иону с четырьмя плюсами. Эта система не должна говорить нам, каковы атомы или ионы в действительности. Вместо этого он помогает нам различать различные состояния атомов или ионов в различных обстоятельствах.
Эта система не должна говорить нам, каковы атомы или ионы в действительности. Вместо этого он помогает нам различать различные состояния атомов или ионов в различных обстоятельствах.
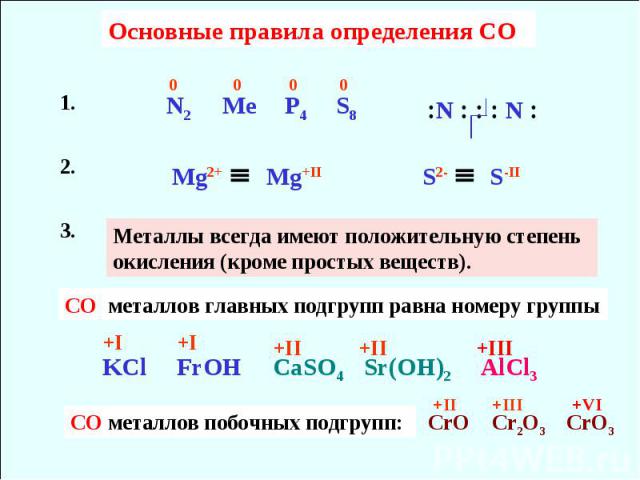
Система, которую придумали химики, представляет собой степень окисления атома или иона, в которой используются степени окисления. Термин «степень окисления» чаще используется, когда мы имеем в виду сам атом или ион, тогда как фраза «степень окисления» чаще используется для обозначения фактического значения. Однако они часто используются взаимозаменяемо; тогда это нормально. Несвязанному атому, подобно атому углерода в газообразном состоянии, присваивается нулевая степень окисления. Простому аниону присваивается степень окисления, эквивалентная его заряду, и мы делаем то же самое для простого катиона.
Важно помнить, что степень окисления не идентична заряду. Заряд атома или иона — это его общий заряд, основанный на относительном количестве электронов и протонов, а степень окисления — это часть системы учета, которая предполагает, что мы имеем дело со 100-процентной ионной связью. Мы пишем степени окисления со знаком слева от числа, а заряды со знаком справа. Конечно, существует множество ситуаций, когда степень окисления и заряд атома или иона совпадают. Но нам нужно различать их, потому что они имеют разные значения.
Мы пишем степени окисления со знаком слева от числа, а заряды со знаком справа. Конечно, существует множество ситуаций, когда степень окисления и заряд атома или иона совпадают. Но нам нужно различать их, потому что они имеют разные значения.
Теперь давайте посмотрим на степени окисления атомов или ионов в различных веществах. Элементарные формы элементов могут быть твердыми, жидкими или газообразными, и у вас могут быть разные аллотропы. Атом элемента, связанный или несвязанный, получает нулевую степень окисления. Если между атомами одного и того же элемента существует ковалентная связь, мы считаем атомы идентичными. Нет разумной причины рассматривать один атом как окисленный, а другой как восстановленный, поэтому мы просто придаем обоим атомам нулевую степень окисления. Следующими по простоте присвоения степеней окисления являются степени окисления простых ионов. Сначала проверяем заряд, идентифицируем значение, а затем переводим в степень окисления, перемещая знак в противоположную сторону.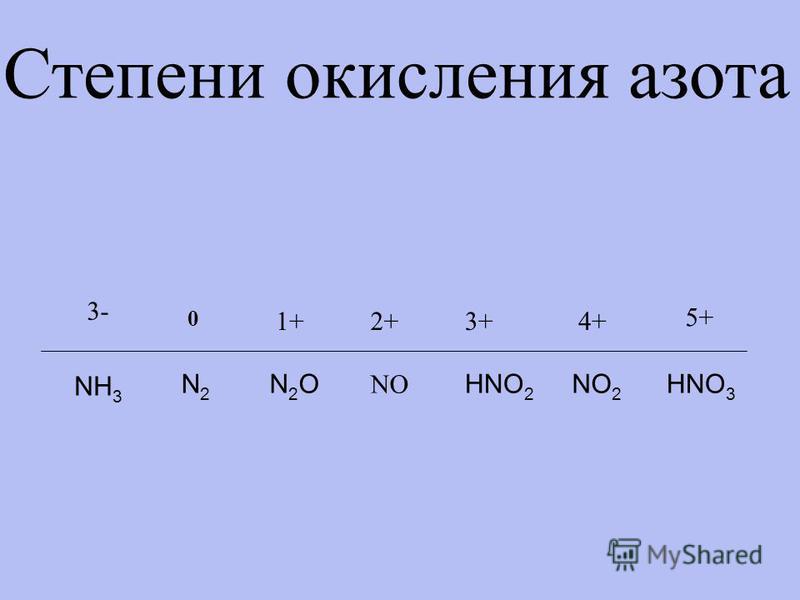 Так, ион натрия имеет степень окисления положительную единицу, ион алюминия имеет степень окисления положительную тройку, а нитрид-ион имеет степень окисления отрицательную тройку.
Так, ион натрия имеет степень окисления положительную единицу, ион алюминия имеет степень окисления положительную тройку, а нитрид-ион имеет степень окисления отрицательную тройку.
А что, если мы имеем дело с простыми ионными соединениями, в которых заряды ионов не указаны? Мы можем использовать то же понимание, которое мы используем, когда вычисляем формулы для ионных соединений, используя заряды, которые мы ожидаем для металлов и неметаллов. Нейтральное ионное соединение должно иметь нулевой суммарный заряд. Числа окисления основаны на тех же принципах сохранения электронов, поэтому применимо то же самое. Для нейтрального соединения сумма степеней окисления отдельных компонентов должна быть равна нулю. Мы можем использовать наше понимание общих ионов, образованных натрием, магнием и кислородом, чтобы выяснить другие ответы.
Многоатомные ионы, ионы, которые содержат более одного ядра, могут быть более хитрыми, например, нитрат-анион, который имеет суммарный заряд минус один. Несмотря на то, что у нас есть чистый заряд, мы можем применить тот же принцип, что и для нейтральных соединений. Степени окисления компонентов должны суммироваться с эквивалентным значением общей загрузки. Общий заряд равен единице минус, поэтому сумма степеней окисления должна быть отрицательной. С левой стороны у нас есть неизвестная степень окисления азота и три партии неизвестной степени окисления кислорода. Кислород более электроотрицательный, чем азот. Итак, мы предсказываем, что в 100-процентной ионной системе кислород в этой системе будет иметь связывающие электроны. Кислород обычно образует два отрицательных иона. Таким образом, мы можем присвоить атомам кислорода степень окисления, равную двум.
Несмотря на то, что у нас есть чистый заряд, мы можем применить тот же принцип, что и для нейтральных соединений. Степени окисления компонентов должны суммироваться с эквивалентным значением общей загрузки. Общий заряд равен единице минус, поэтому сумма степеней окисления должна быть отрицательной. С левой стороны у нас есть неизвестная степень окисления азота и три партии неизвестной степени окисления кислорода. Кислород более электроотрицательный, чем азот. Итак, мы предсказываем, что в 100-процентной ионной системе кислород в этой системе будет иметь связывающие электроны. Кислород обычно образует два отрицательных иона. Таким образом, мы можем присвоить атомам кислорода степень окисления, равную двум.
Если мы оценим наше выражение и перестроим, мы получим степень окисления азота, равную положительной пятерке. В уравнениях вы можете увидеть степени окисления, написанные цифрами или римскими цифрами над символом элемента. Только будьте осторожны, чтобы не вернуться назад; то, что мы присвоили этому азоту степень окисления, равную пяти, еще не означает, что на самом деле мы имеем дело с ионом азота пять плюс. Числа окисления позволяют нам сравнивать атомы или ионы в различных обстоятельствах. Они не обязательно отражают заряд атомов или ионов в реальности.
Числа окисления позволяют нам сравнивать атомы или ионы в различных обстоятельствах. Они не обязательно отражают заряд атомов или ионов в реальности.
Давайте рассмотрим еще один пример, ион перманганата. Когда металл и неметалл реагируют, мы ожидаем, что неметалл образует анионы, а металл — катионы. Итак, здесь мы ожидаем, что кислород будет в форме O2-. Опять же, мы имеем дело с ионом с общим зарядом один минус. Таким образом, сумма степеней окисления должна быть отрицательной. С четырьмя кислородами у нас есть четыре партии отрицательных двух степеней окисления. Когда мы оцениваем и переставляем, мы получаем степень окисления марганца, равную положительной семерке.
Далее, многоатомные ионы могут входить в состав ионных соединений, как и простые ионы. Например, для карбоната кальция отправной точкой является знание того, что общий ион для кальция — это кальций два плюс. Итак, для баланса заряд иона углерода должен быть равен двум минус. Создать этот простой ион легко, и мы можем создать карбонат точно так же, как мы сделали любой другой многоатомный ион. Как и прежде, мы будем считать, что кислород имеет степень окисления, равную двум. Когда мы оцениваем и перегруппировываем, мы получаем степень окисления углерода, равную четырем.
Как и прежде, мы будем считать, что кислород имеет степень окисления, равную двум. Когда мы оцениваем и перегруппировываем, мы получаем степень окисления углерода, равную четырем.
Вот и все простые категории для присвоения степеней окисления, давайте перейдем к более сложным. Это ковалентные вещества, такие как углерод, монооксид углерода и диоксид углерода. Для чистого углерода степень окисления устанавливается равной нулю, но мы должны выяснить степени окисления углерода в монооксиде углерода и диоксиде углерода. Чтобы понять это, нам нужно помнить, что типичная степень окисления кислорода в соединении — минус два. Для углерода и двуокиси углерода степень окисления равна двум. Здесь мы исходили из того, что сумма степеней окисления равна нулю. Когда мы делаем то же самое для углекислого газа, мы должны быть осторожны, умножая степень окисления кислорода на два. Это дает нам степень окисления углерода положительной четверки.
Но есть необычный пример, перекись водорода. Если бы степень окисления кислорода и перекиси водорода была равна двум отрицательным, то степень окисления водорода должна была бы равняться двум положительным. Атомы водорода имеют только один электрон. Таким образом, нет смысла говорить о водороде в степени окисления плюс два, поскольку это было бы эквивалентно потере двух электронов. Итак, что здесь происходит на самом деле?
Если бы степень окисления кислорода и перекиси водорода была равна двум отрицательным, то степень окисления водорода должна была бы равняться двум положительным. Атомы водорода имеют только один электрон. Таким образом, нет смысла говорить о водороде в степени окисления плюс два, поскольку это было бы эквивалентно потере двух электронов. Итак, что здесь происходит на самом деле?
Это структура молекулы перекиси водорода. Кислород гораздо более электроотрицательный, чем водород, поэтому электроны в кислородно-водородных связях оказываются ближе к атомам кислорода. Но электроны в связи кислород-кислород находятся ровно посередине. Если мы попытаемся сделать эту систему на 100 % ионной, эта кислородно-кислородная связь создаст проблему. Неразумно говорить, что один атом теряет электроны, а другой атом приобретает электроны. Так что в этом случае мы сохраняем связь. В итоге мы получаем ионы H+ и ионы O-. Вот почему мы видим кислород с отрицательной степенью окисления, когда он находится в перекиси.
Это нужно запомнить. К счастью, существует система правил, которые могут помочь найти ответ. Их легко запомнить с помощью 123FHOC. Номер один относится к группе один. Мы предполагаем, что в соединении металлы первой группы будут иметь положительную степень окисления. Далее металлы группы два, которым мы присваиваем степень окисления плюс два. И мы присваиваем положительную тройку членам группы три. Помните, что если правило стоит первым в последовательности, оно получает приоритет.
Следующее правило состоит в том, что фтор в соединении всегда будет иметь отрицательную степень окисления. И правило водорода говорит, что степень окисления водорода будет положительной, за исключением гидридов, где мы видим ион H-. В этом примере легко понять, что мы имеем дело с гидридом, поскольку мы сначала используем правило группы один. Если натрий положительный, то водород должен быть отрицательным. Во всех гидридах степень окисления водорода отрицательная. Далее следует кислородное правило, согласно которому кислород в соединениях обычно имеет степень окисления, равную двум, за исключением пероксидов, где степень окисления равна отрицательной единице. И C в 123FHOC не для углерода; это для хлора. В соединениях хлор будет иметь отрицательную степень окисления, если только он не связан с фтором или кислородом.
И C в 123FHOC не для углерода; это для хлора. В соединениях хлор будет иметь отрицательную степень окисления, если только он не связан с фтором или кислородом.
Если вы помните эти правила, вы сможете определить неизвестные степени окисления в незнакомых соединениях. Только имейте в виду, что эти правила работают не во всех случаях. Иногда нам нужно выполнять высокоуровневые вычисления. Однако эти правила будут применяться в большинстве случаев. Вам, скорее всего, придется вычислять степени окисления, когда вы смотрите на реакции. Мы можем проанализировать степени окисления, чтобы определить, является ли конкретная реакция окислительно-восстановительным или неокислительно-восстановительным процессом.
Вот реакция оксида магния с соляной кислотой. Мы можем использовать мнемонику 123FHOC, чтобы напомнить себе, какие правила мы должны соблюдать в первую очередь. Здесь нет металлов первой группы, но мы можем использовать правило двух, чтобы присвоить магнию степень окисления. Поскольку мы имеем дело с соединениями магния, степень окисления магния будет положительной двойки. Нет никаких элементов третьей группы, и нет фтора. Итак, мы можем пропустить эти правила и просто посмотреть на водород. В HCl и h3O водород является первым элементом, которому присвоена степень окисления, поэтому мы можем быть уверены, что присвоим ему положительную степень окисления.
Поскольку мы имеем дело с соединениями магния, степень окисления магния будет положительной двойки. Нет никаких элементов третьей группы, и нет фтора. Итак, мы можем пропустить эти правила и просто посмотреть на водород. В HCl и h3O водород является первым элементом, которому присвоена степень окисления, поэтому мы можем быть уверены, что присвоим ему положительную степень окисления.
Далее у нас есть кислородное правило. Но в обоих случаях кислород является последним элементом, который следует присвоить соединению. Таким образом, мы можем игнорировать кислородное правило и вместо этого определить степень окисления кислорода на основе общей степени окисления соединения. В оксиде магния кислород будет иметь отрицательную степень окисления два, чтобы противодействовать положительной степени окисления магния. А в воде кислород снова будет иметь отрицательную степень окисления два, уравновешивающую две положительные степени водорода. Нам нужно учитывать степени окисления обоих атомов водорода, но обычно мы пишем только одну над символом элемента.
Теперь мы можем перейти к правилу хлора. Опять же, в обоих соединениях, где у нас есть хлор, хлор является последним элементом, которому присваивается степень окисления. Так, в HCl хлор должен иметь отрицательную степень окисления, то же самое и в хлориде магния. Нам нужно, чтобы каждый хлор имел отрицательную степень окисления, чтобы сбалансировать положительные два магния. Но по соглашению мы пишем отрицательное только один раз. Теперь давайте посмотрим, произошло ли какое-либо восстановление или окисление. Степень окисления магния не изменилась. Он остался на положительном уровне два, и никаких изменений для кислорода, водорода или хлора не произошло. Следовательно, это неокислительно-восстановительная реакция.
Далее рассмотрим реакцию между элементарным кальцием и серной кислотой. Мы можем пропустить первое правило, потому что в нем нет элементов первой группы, и перейти ко второму правилу с кальцием. Но правила применяются только к веществам в соединениях. Кальций в своей элементарной форме будет иметь степень окисления, равную нулю. Но кальций и сульфат кальция будут иметь степень окисления, равную двум положительным. Далее мы переходим к правилу водорода. У нас есть h3, который представляет собой водород в элементарной форме. Так вот, степень окисления водорода здесь нулевая, а у серной кислоты положительная.
Но кальций и сульфат кальция будут иметь степень окисления, равную двум положительным. Далее мы переходим к правилу водорода. У нас есть h3, который представляет собой водород в элементарной форме. Так вот, степень окисления водорода здесь нулевая, а у серной кислоты положительная.
Далее у нас есть кислородное правило. В серной кислоте и сульфате кальция кислород не является последним элементом, которому присвоена степень окисления. Итак, мы можем использовать правило. Таким образом, в обоих случаях степень окисления кислорода равна двум отрицательным. У нас больше не осталось правил. Итак, мы должны выяснить степень окисления серы по старинке. Сумма степеней окисления серной кислоты должна равняться нулю. Итак, мы можем расширить все степени окисления для водорода и кислорода. У нас есть избыток минус шесть. Таким образом, степень окисления серы должна быть положительной шестью.
Сульфатная группа в сульфате кальция идентична серной кислоте. Так, сера в сульфате кальция тоже должна иметь степень окисления плюс шесть. В этом уравнении мы видим, как кальций переходит от нулевой степени окисления к степени окисления положительной двойки. Это окисление. И мы также можем видеть, что водород восстанавливается, переходя от положительной степени окисления к нулю. Итак, мы продемонстрировали, что имеем дело с окислительно-восстановительной реакцией.
В этом уравнении мы видим, как кальций переходит от нулевой степени окисления к степени окисления положительной двойки. Это окисление. И мы также можем видеть, что водород восстанавливается, переходя от положительной степени окисления к нулю. Итак, мы продемонстрировали, что имеем дело с окислительно-восстановительной реакцией.
Существует также особый тип окислительно-восстановительной реакции, называемый диспропорционированием. В реакции диспропорционирования мы видим, что одно вещество одновременно подвергается восстановлению и окислению. Когда перекись водорода разлагается, один из атомов кислорода переходит из степени окисления отрицательной единицы в нулевую степень окисления. Итак, он окисляется, а другой восстанавливается, переходя от степени окисления «минус один» к степени окисления «минус два». Восстановление и окисление происходят одновременно с одним и тем же химическим веществом.
Теперь давайте закончим с ключевыми моментами. Мы можем думать о степени окисления просто как о счетном числе, эквивалентном заряду атома или иона в 100-процентной ионной системе.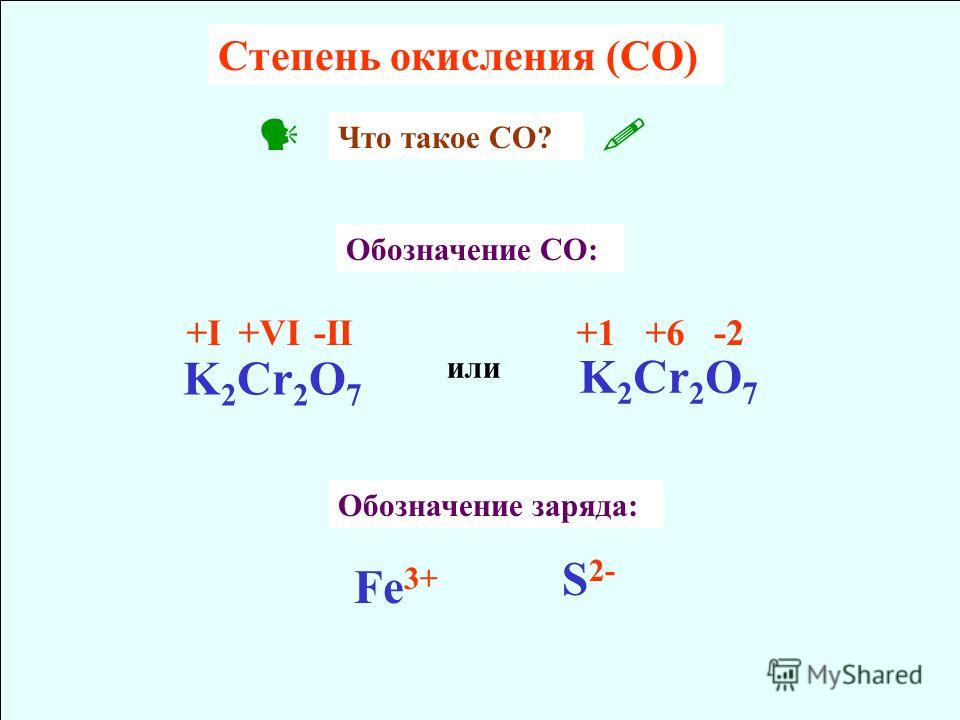

 Реакция протекает при 100 °C.
Реакция протекает при 100 °C.