Валентность кремния — основные валентные возможности и степени окисления
Валентность кремния, возможности которой изучаются в химии, отличается в зависимости от соединений и модификаций. Это второй по распространенности элемент в коре Земли. Он имеет свойства как окислителя, так и восстановителя. Его ценность заключается в массовом использовании для электронной промышленности и проводниковых элементов.
Содержание
- Общие сведения
- Модификации и нахождение
- Способы получения и свойства
Общие сведения
Вещество является элементом четырнадцатой группы третьего периода системы химических элементов, атомное число равно 14. Электронное строение, которое влияет на степень окисления кремния, отражается конфигурацией в виде подуровней 1S2 2S2 2P6 3S2 3P2. На внешнем орбитальном уровне находятся 4 электрона. Соответственно, максимальная валентность кремния составляет 4. +2 становится восстановителем;
+2 становится восстановителем;
Элемент является типичным неметаллом. Силициум в зависимости от превращения может проявлять свойства как окислителя, так и восстановителя. Для SiO2 степень окисления также зависит от реакции, в которой он участвует.
Модификации и нахождение
Различают аморфный и кристаллический кремний. Первая аллотропная модификация представлена в виде бурого порошка. Структура разупорядоченная, напоминает алмаз. Обладает сильной способностью к реакции. Твердый силициум имеет темно-серый оттенок с металлическим блеском. Структура кубическая, по способности к реагированию проявляет минимальный эффект.
В свободной форме силициум и SiO3 (участие кислорода) не встречается, представлен только в виде соединений. Наиболее устойчив в состоянии оксида кремния или кремнезема. В природе встречается в виде песка и таких минералов, как кварц и горный хрусталь.
В природе встречается в виде песка и таких минералов, как кварц и горный хрусталь.
Важно отметить, что неметалл входит в состав как камней в виде аметиста и яшмы, так и минералов. Основными группами являются силикаты и алюмосиликаты — это полевые шпаты, глины, слюда и другие компоненты, какие можно встретить в природе.
Способы получения и свойства
Кремний используется для создания различных полупроводниковых элементов (включая солнечные батареи), сплавов, восстановления металлов. Способы получения высоких и низких вариантов кремния:

Кремний является темно-серым веществом. Он хрупкий и тугоплавкий, имеет полупроводниковые свойства. При взаимодействии с металлами образуются силициды вида Ca2Si или Mg2Si. Из-за высокой инертности неметалл взаимодействует только с фтором, проявляя свойства восстановителя. С хлором реакция идет только при нагревании от 400 до 600 градусов.
Создание SiO возможно при нагревании. Когда температура будет равна 2000 °C, образуется карборунд, а если возбудить до 1000 °C, то можно получить нитрид кремния. Непосредственного контакта с водородом не имеется, получение силана возможно только косвенными путями.
Что касается сложных веществ, то силициум очень устойчив к воздействию кислот, в такой среде он может занимать пространство пленкой оксида. Взаимодействие становится возможным только со смесью двух кислот — плавиковой и азотной. Со щелочами идет активная реакция, в которой проявляются слабокислые свойства. Галогеноводородные кислоты помогают образовать галогениды силициума.
Со щелочами идет активная реакция, в которой проявляются слабокислые свойства. Галогеноводородные кислоты помогают образовать галогениды силициума.
Это основные химические свойства, которые наблюдаются у силициума. Он проявляет разные степени валентности, в зависимости от степени окисления и соединений.
Элемент активно используют в полупроводниковых элементах и других областях электроники. Можно добыть как в лабораторных, так и в промышленных условиях с применением высоких температур и катализаторов. Важно внимательно рассмотреть взаимодействие с металлами и кислотами, так как они влияют на степень окисления и валентные электроны.
Предыдущая
ХимияМел — свойства, происхождение и применение
Следующая
ХимияХимическая лабораторная посуда — описание, виды и назначение
Соединения кремния и их свойства 9 класс онлайн-подготовка на Ростелеком Лицей
Кремний как химический элемент
Кремний как химический элемент. На внешнем слое в атоме кремния 4 электрона (рис. 1).
На внешнем слое в атоме кремния 4 электрона (рис. 1).
Рис. 1. Электроны в атоме кремния
Кремний – элемент третьего периода, а значит, радиус его атома больше, чем углерода. Отсюда следует, что внешние электроны кремния слабее притягиваются к ядру, и его относительная электроотрицательность будет меньше, чем углерода.
Кремний может проявлять степень окисления -4 в соединениях с металлами. В большинстве остальных соединений кремний проявляет степень окисления +4 (рис. 2).
Рис. 2. Степени окисления кремния
Свойства простого вещества кремния
Для кремния известны две аллотропные модификации. Наиболее устойчивая аллотропная модификация кремния имеет строение, подобное алмазу, т. е. атомное строение. Это тугоплавкое, твердое, но хрупкое вещество, черно-серого цвета (рис. 3).
Рис. 3. Кремний
Химические свойства кремния во многом подобны углероду. Для него характерны реакции с кислородом, галогенами и металлами. В отличие от углерода, кремний не взаимодействует с водородом. Его водородное соединение получают с помощью реакции между силицидом магния и соляной кислотой.
В отличие от углерода, кремний не взаимодействует с водородом. Его водородное соединение получают с помощью реакции между силицидом магния и соляной кислотой.
Si + O2 = SiO2
Si + 2Cl2 = SiCl4
2Mg + Si = Mg2Si
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
Наиболее характерная степень окисления кремния +4. Рассмотрим свойства некоторых соединений кремния, в которых он проявляет степень окисления +4.
Оксид кремния (IV)
Оксид кремния (IV), или кремнезем – тугоплавкий, нелетучий, практически нерастворимый в воде. Специально приготовленный порошок оксида кремния (силикагель) используется в качестве адсорбента (рис. 4). Гранулированный силикагель используется для осушки воздуха.
Рис. 4. Силикагель
По своей структуре оксид кремния представляет собой неорганический полимер, в котором атомы кремния и кислорода, связанные между собой, образуют своеобразные цепочки, ленты и сетки. Этим и объясняется тугоплавкость и твердость оксида кремния.
Этим и объясняется тугоплавкость и твердость оксида кремния.
В природе встречаются многие разновидности кремнезема. Главным образом, это кварц, который известен в виде обычного песка или крупных кристаллов. Некоторые разновидности кварца имеют особые названия: горный хрусталь, аметист, дымчатый топаз, агат и яшма и другие.
По химическим свойствам оксид кремния – кислотный оксид, а значит, он вступает в реакции со щелочами, при этом образуются силикаты. Например, при взаимодействии оксида кремния с избытком гидроксида калия образуются силикат калия и вода
SiO2 + 2KOH = K2SiO3 + H2O
При сплавлении он взаимодействует с основными оксидами, например с оксидом кальция:
CaO + SiO2 = CaSiO3
В ряду специфических свойств оксида кремния следует отметить его растворение в плавиковой кислоте (поскольку оксид кремния является одной из составных частей любого стекла, эта реакция называется реакцией «травления стекла»):
SiO2 + 4HF = SiF4 + 2H2O
Оксид кремния не взаимодействует с водой, но ему соответствует кремниевая кислота H2SiO3.
Кремниевая кислота
Правильнее формулу кремниевой кислоты следует записывать так: SiO2*nH2O, т. к. она не имеет постоянного состава. Кремниевая кислота нестойкая и со временем разлагается на оксид кремния и воду:
Н2SiO3 = SiO2 + H2O
Соли кремниевой кислоты – силикаты. Большинство силикатов не растворяется в воде. Их строение в основном сходно со строением оксида кремния. Поэтому силикаты тоже тугоплавкие вещества.
Так как кремниевая кислота – очень слабая, то из своих солей она вытесняется не только сильными кислотами, но и угольной кислотой, которая сильнее ее:
Na2SiO3 + H2O + CO2 = Na2CO3 + H2SiO3↓
Список литературы
- Микитюк А. Д. Сборник задач и упражнений по химии. 8–11 классы / А. Д. Микитюк. – М.: Изд. «Экзамен», 2009 (с.

- Оржековский П. А. Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007 (с. 124–128).
- Оржековский П. А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007 (§40).
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008 (с. 78–79).
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003 (с. 207–212).
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
Домашнее задание
- Оржековский П. А. Химия: 9-й класс: учеб.
 для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2.
для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2. - Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007. – с. 126 № 512.
Кремний. Химия кремния и его соединений
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7. 2.1. Взаимодействие с щелочами
2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2.1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.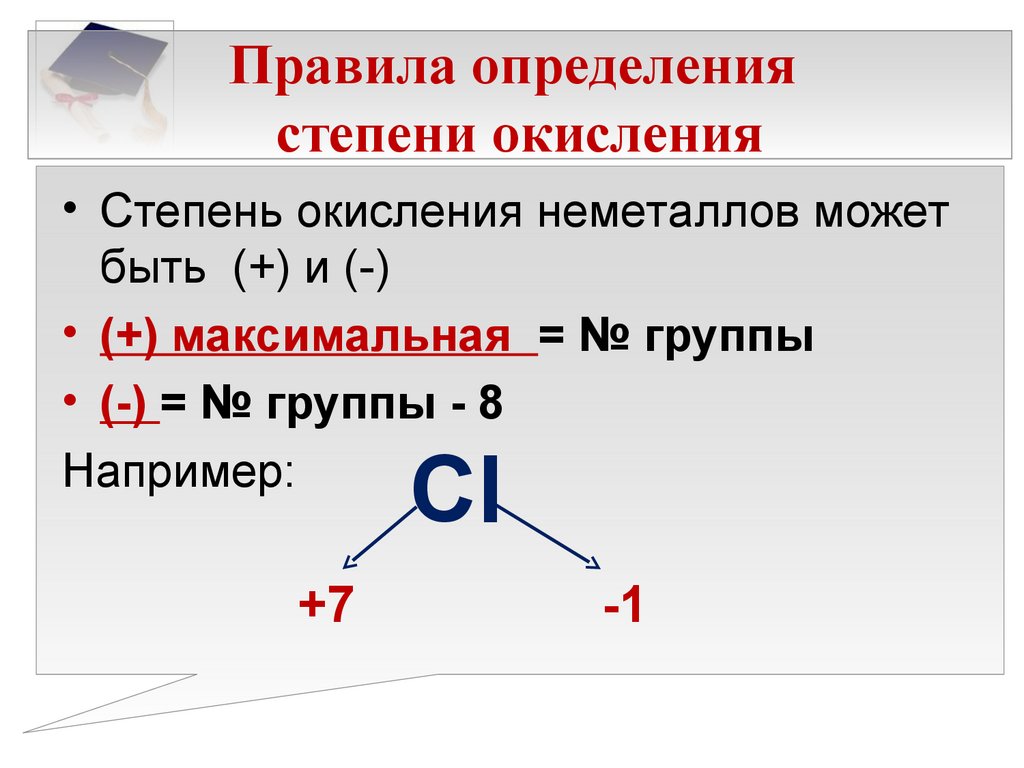 И. Менделеева.
И. Менделеева.
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.
Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl
Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1. 5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв. ) + 4HF(г.) = SiF4 + 2H2
) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:
Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т. к. кремниевая кислота нерастворима.
к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 4HF(г) = SiF4 + 2H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.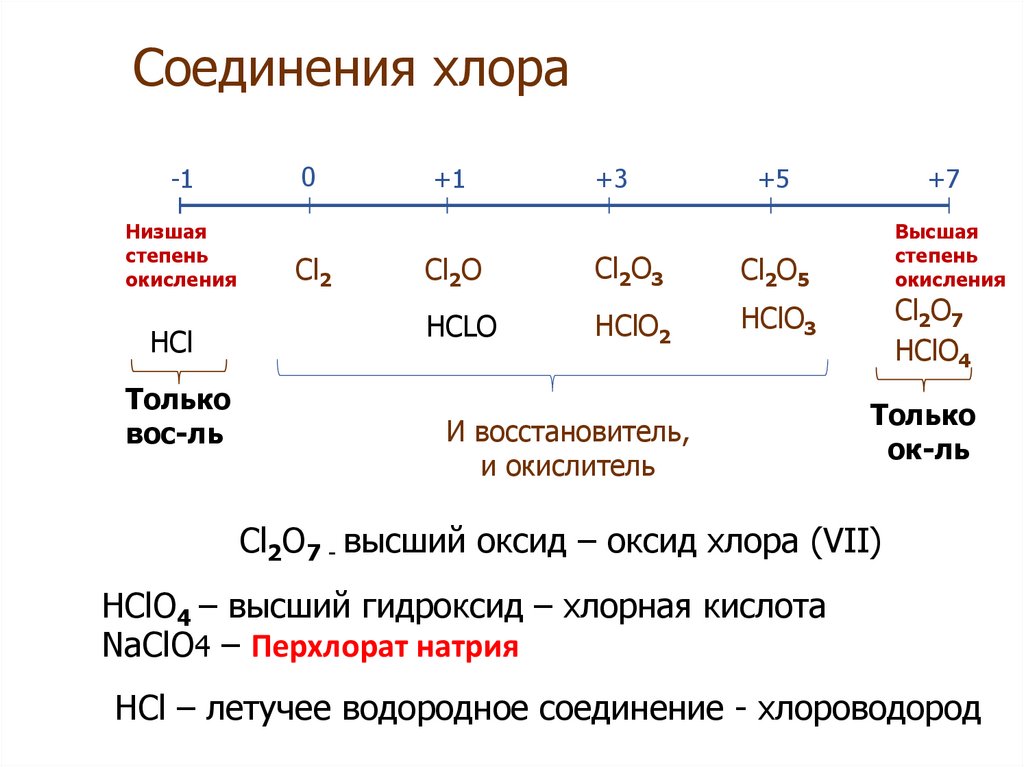
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.
Образует коллоидный раствор в воде.
Метакремниевая H2SiO3 существует в растворе в виде полимера:
Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидроксидом калия:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + 2H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Понравилось это:
Нравится Загрузка…
Раздел недели: Плоские фигуры. Свойства, стороны, углы, признаки, периметры, равенства, подобия, хорды, секторы, площади и т.д. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Химический справочник / / Таблица Менделеева. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator Free xml sitemap generator | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Элементы IVА группы. Кремний — Умскул Учебник
На этой странице вы узнаете:- Физические и химические свойства кремния;
- Песок тоже с кремнием: разберем соединения кремния — силаны, оксиды, силикаты;
- Единственная и неповторимая — поговорим о свойствах кремниевой кислоты.
В чайном сервизе твоей бабушки обязательно найдется кремний, так как диоксид кремния входит в состав стекла. Ну а загорать на пляже без песочка (SiO2) ну просто невозможно (песок встречается на каждом шагу).
Кремний
Кремний встречается во многих веществах и предметах, которые нас окружают. Достаточно вспомнить только солнечные батареи, которые служат альтернативным источником энергии!
Так что же из себя представляет кремний? Он, как и углерод, находится в IVA-группе и имеет конфигурацию внешнего электронного слоя 3s23p2.
В возбужденном состоянии электроны на s-орбитали распариваются, и один из них переселяется на p-орбиталь. В результате, атом приобретает конфигурацию ns1np3.
В возбужденном состоянии число неспаренных атомов кремния возрастает до четырех, и кремний приобретает валентность IV:
У кремния возможны следующие степени окисления: -4, +2, +4.
Физические свойства| Кремний — второй по распространенности элемент на Земле (после кислорода). Кремний встречается только в виде сложных веществ, таких как горный хрусталь, кварц, кремнезем. |
Кристаллическая решётка простого вещества кремния — атомная, сам кремний представляет собой вещество темно-серого цвета с металлическим блеском. Является полупроводником.
Химические свойства кремнияУ кремния относительно низкая электроотрицательность. А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
А что это значит? Это значит, что он будет яро проявлять восстановительные свойства, даже ещё более выраженные чем у углерода! Поэтому из неметаллов будет вступать в реакции с типичными окислителями, повышая свою степень окисления до +4:
- Реакции с неметаллами
| Кремний не реагирует с водородом и фосфором в силу близких значений электроотрицательностей! |
- Реакция со щелочами
В отличие от других неметаллов, реагирующих со щелочами, кремний является в этих реакциях только восстановителем, повышая степень окисления до +4:
- А с окислителями реакция идет?
Конечно! Но не со всеми. Отобрать электроны «слабенький» кремний способен только у самых слабых — у металлов. Как и углерод, кремний реагирует в основном с металлами активными и средней активности, образуя силициды:
Как и многие другие бинарные соединения, силициды металлов могут гидролизоваться:
Образующийся бесцветный газ с неприятным запахом — силан — за счёт степени окисления кремния -4 проявляет восстановительные свойства и способен реагировать с окислителями (например, с кислородом):
(оксид кремния(IV) входит в состав песка, который мы видим на улице)
Получение кремния
Кремний в основном получают восстановлением из диоксида кремния SiO2 сильными восстановителями: углеродом, металлами:
Оксид кремния (IV) — кремнезём SiO2Диоксид кремния — кислотный оксид, главный компонент почти всех земных горных пород. Из кремнезема и силикатов состоит почти 90 % массы литосферы.
Из кремнезема и силикатов состоит почти 90 % массы литосферы.
- Реакция с водой
Почему же диоксид кремния такой исключительный? Да все потому, что это — единственный кислотный оксид, который не реагирует с водой! Как следствие, ему соответствует нерастворимая кремниевая кислота H2SiO3.
- Основно-кислотное взаимодействие
Как кислотный оксид, SiO2 проявляет кислотные свойства, а значит, способен взаимодействовать с веществами, проявляющими основные свойства, с образованием солей — силикатов:
- А в реакции вытеснения вступает?
Да! SiO2 в реакциях вытеснения — условно «сильный» оксид, способный вытеснять условно «слабые» (CO2, SO2) из их солей при сплавлении (t):
- Реакции с окислителями
За счёт высокой степени окисления кремния +4 SiO2 проявляет слабо выраженные окислительные свойства и может вступать в ОВР, как правило, только с очень сильными восстановителями (например, углеродом или металлами):
Единственная и неповторимая — кремниевая кислота и силикатыКремниевая кислота, хоть и нерастворима, но всё-таки проявляет кислотные свойства, взаимодействуя с сильными основаниями (щелочами):
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Её соли — силикаты, как и другие соли, являются электролитами, а значит, способны вступать в РИО с другими электролитами: солями, основаниями, кислотами:
Как нерастворимый гидроксид, кремниевая кислота способна разлагаться при нагревании на воду и соответствующий оксид:
Фактчек- Кремний — химический элемент IVA группы, третьего периода периодической системы химических элементов Д.
 И. Менделеева, с атомным номером 14.
И. Менделеева, с атомным номером 14. - Возможные степени окисления кремния: -4, +2, +4.
- Электронная конфигурация атома кремния: 1s22s22p63s13p3.
- Кремний за счёт низкой электроотрицательности ярко проявляет восстановительные свойства.
- Кремний образует множество соединений, в том числе оксид кремния SiO2 — кислотный оксид, который соответствует кремниевой кислоте H2SiO3. Соли кремниевой кислоты называются силикатами.
Задание 1.
Сколько неспаренных электронов содержит атом кремния в возбужденном электронном состоянии?
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.

Задание 2.
С каким из следующих простых веществ не реагирует кремний?
- Углерод;
- Бром;
- Фосфор;
- Кислород.
Задание 3.
С каким из перечисленных веществ будет реагировать диоксид кремния?
- Карбонат натрия;
- Сульфат калия;
- Хлорид рубидия;
- Ортофосфат кальция.
Задание 4.
Какое свойство отличает кремниевую кислоту от других кислот?
- Она содержит атомы кислорода;
- При комнатной температуре кремниевая кислота — жидкость;
- Она нерастворима в воде;
- Она проявляет амфотерные свойства.
Задание 5.
Как называются бинарные соединения кремния и металлов?
- Силаны;
- Силициды;
- Силикаты;
- Силоксаны.
Ответы: 1. — 4; 2. — 3; 3. — 1; 4. — 3; 5. — 2.
— 2.
Фторид кремния(IV), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
ТЕНДЕНЦИИ СОСТОЯНИЯ ОКИСЛЕНИЯ В ГРУППЕ 4 На этой странице исследуются степени окисления (степени окисления), показанные элементами группы 4 — углеродом (C), кремнием (Si), германием (Ge), оловом (Sn) и свинцом (Pb). В нем рассматривается возрастающая склонность элементов к образованию соединений, в которых их степень окисления равна +2, особенно в отношении олова и свинца. | ||
Примечание: Если вас не устраивают процессы окисления и восстановления (включая использование степеней окисления), обязательно перейдите по этой ссылке, прежде чем двигаться дальше. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | ||
Некоторые примеры тенденций изменения степеней окисления Общий тренд Типичная степень окисления элементов группы 4 равна +4, она встречается в таких соединениях, как CCl 9. | ||
Предупреждение: Не попадитесь в ловушку, цитируя CH 4 в качестве примера углерода с типичной степенью окисления +4. Поскольку углерод более электроотрицателен, чем водород, его степень окисления в данном случае равна -4! | ||
Однако по мере продвижения вниз по Группе появляется все больше и больше примеров, где степень окисления равна +2, например, SnCl 2 , PbO и Pb 2+ . В случае с оловом состояние +4 по-прежнему более стабильно, чем +2, но к тому времени, когда вы доберетесь до свинца, состояние +2 станет более стабильным и доминирует в химическом составе свинца. Пример из химии углерода Единственный распространенный пример степени окисления +2 в химии углерода встречается в монооксиде углерода, CO. Оксид углерода является сильным восстановителем, поскольку он легко окисляется до диоксида углерода, где степень окисления +4 является более термодинамически стабильной. Например, моноксид углерода восстанавливает многие оксиды горячего металла до металла — реакция, которая используется, например, при извлечении железа в доменной печи. Примеры из химии олова К тому времени, когда вы дойдете до олова в группе, состояние +2 станет все более распространенным, и существует хороший диапазон соединений как олова (II), так и олова (IV). Однако олово (IV) по-прежнему является более стабильной степенью окисления олова. Это означает, что будет довольно легко преобразовать соединения олова (II) в соединения олова (IV). Лучше всего это проявляется в том, что ионы Sn 2+ в растворе являются хорошими восстановителями. Например, раствор, содержащий ионы олова (II) (например, раствор хлорида олова (II)), восстановит раствор йода до ионов йодида. При этом ионы олова (II) окисляются до ионов олова (IV). | ||
Примечание: Для простоты я пишу это уравнение (и следующие несколько), как если бы продукт содержал простые ионы олова (IV).  На самом деле простых ионов олова (IV) в растворе не существует. В этих примерах они обычно будут частью гораздо более крупного комплексного иона. Не беспокойтесь об этом на этом уровне. На самом деле простых ионов олова (IV) в растворе не существует. В этих примерах они обычно будут частью гораздо более крупного комплексного иона. Не беспокойтесь об этом на этом уровне. | ||
Ионы олова (II) также восстанавливают ионы железа (III) до ионов железа (II). Например, раствор хлорида олова (II) восстанавливает раствор хлорида железа (III) до раствора хлорида железа (II). При этом ионы олова (II) окисляются до более стабильных ионов олова (IV). Ионы олова (II), конечно, также легко окисляются сильными окислителями, такими как подкисленный раствор манганата калия (VII) (раствор перманганата калия). Эту реакцию можно использовать в качестве титрования для определения концентрации ионов олова (II) в растворе. | ||
Примечание: Если вас не устраивают расчеты титрования (в том числе расчеты с использованием манганата калия (VII)), вас может заинтересовать моя книга по химическим расчетам.  | ||
И напоследок. . . В органической химии олово и концентрированная соляная кислота традиционно используются для восстановления нитробензола до фениламина (анилина). В этой реакции олово сначала окисляется до ионов олова (II), а затем до предпочтительных ионов олова (IV). | ||
Примечание: Эта реакция подробно описана в разделе сайта, посвященном органической химии, на странице, посвященной получению фениламина. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу, если вы решите перейти по этой ссылке. | ||
Примеры из химии свинца Со свинцом ситуация обратная. На этот раз степень окисления свинца (II) более стабильна, и соединения свинца (IV) имеют сильную тенденцию реагировать с образованием соединений свинца (II). Хлорид свинца(IV), например, разлагается при комнатной температуре с образованием хлорида свинца(II) и газообразного хлора: . Оксид свинца(IV) также реагирует с концентрированной соляной кислотой, окисляя часть ионов хлорида в кислоте до газообразного хлора. И снова опережение уменьшается с +4 до более стабильного состояния +2. Попытка объяснить тенденции изменения степеней окисления Нет ничего удивительного в нормальной степени окисления группы +4. Все элементы группы имеют внешнюю электронную структуру ns 2 np x 1 np y 1 , где n изменяется от 2 (для углерода) до 6 (для свинца). Степень окисления +4 — это когда все эти внешние электроны непосредственно участвуют в связывании. По мере того, как вы приближаетесь к нижней части группы, наблюдается растущая тенденция к тому, чтобы пара s 2 не использовалась в соединении. Это часто называют эффект инертных пар — и является доминирующим в химии свинца. Однако само название «эффект инертной пары» ничего не объясняет. Вам нужно рассмотреть два разных объяснения в зависимости от того, говорите ли вы об образовании ионных или ковалентных связей. | ||
Примечание: Следующее, скорее всего, будет далеко за пределами того, что вам нужно для уровня UK A (или его эквивалента) — , и приведено в основном для интереса. Чтобы быть уверенным, обратитесь к своему учебному плану и, что более важно, к прошлым экзаменационным работам и схемам оценок. Если вы готовитесь к экзамену в Великобритании и у вас его нет, перейдите по этой ссылке на страницу учебных программ, чтобы узнать, как их получить. | ||
Эффект инертной пары при образовании ионных связей Если элементы группы 4 образуют ионы 2+, они потеряют p-электроны, оставив пару s 2 неиспользованной. Например, чтобы сформировать ион свинца (II), свинец потеряет два 6p-электрона, но 6s-электроны останутся неизменными — «инертная пара». Обычно вы ожидаете, что энергия ионизации будет падать по мере того, как вы спускаетесь вниз по группе по мере того, как электроны удаляются от ядра. В группе 4 этого не происходит. На этой первой диаграмме показано, как меняется общая энергия ионизации, необходимая для образования ионов 2+, по мере продвижения вниз по Группе. Все значения даны в кДж моль -1 . Обратите внимание на небольшое увеличение между оловом и свинцом. Это означает, что удалить р-электроны из свинца несколько труднее, чем из олова. Однако, если вы посмотрите на картину потери всех четырех электронов, разница между оловом и свинцом будет гораздо заметнее. Относительно большое увеличение между оловом и свинцом должно быть связано с тем, что пару 6s 2 значительно труднее удалить из свинца, чем соответствующую пару 5s 2 из олова. Опять же, все значения даны в кДж·моль -1 , и обе диаграммы имеют приблизительно одинаковый масштаб. Причины всего этого кроются в Теории Относительности. С более тяжелыми элементами, такими как свинец, есть то, что известно как релятивистское сжатие электронов, которое стремится притянуть электроны ближе к ядру, чем можно было бы ожидать. Поскольку они ближе к ядру, их труднее удалить. Чем тяжелее элемент, тем сильнее этот эффект. Это влияет на s-электроны гораздо больше, чем на p-электроны. В случае свинца релятивистское сжатие делает удаление 6s-электронов энергетически более трудным, чем можно было бы ожидать. Энерговыделения при образовании ионов (таких как энтальпия решетки или энтальпия гидратации) явно недостаточно, чтобы компенсировать эту дополнительную энергию. Это означает, что для свинца не имеет энергетического смысла образовывать ионы 4+. | ||
Примечание: Если вы хотите узнать больше о релятивистском сжатии, попробуйте поискать в Google релятивистских сжатых электронов — но ожидайте, что вам придется много читать! | ||
Эффект инертной пары при образовании ковалентных связей Вам нужно подумать, почему углерод обычно образует четыре ковалентные связи, а не две. Используя обозначение «электроны в ящиках», внешняя электронная структура углерода выглядит следующим образом: Есть только два неспаренных электрона. Однако прежде чем углерод образует связи, он обычно переводит один из s-электронов на пустую р-орбиталь. Остаются 4 неспаренных электрона, которые (после гибридизации) могут образовывать 4 ковалентные связи. Стоит поставлять энергию для продвижения s-электрона, потому что тогда углерод может образовать в два раза больше ковалентных связей. Каждая образующаяся ковалентная связь высвобождает энергию, и этого более чем достаточно для снабжения энергией, необходимой для продвижения. Одно из возможных объяснений нежелания свинца делать то же самое заключается в падении энергии связи по мере продвижения вниз по Группе. Энергия связи имеет тенденцию падать по мере того, как атомы становятся больше, а связывающая пара находится дальше от двух ядер и лучше экранируется от них. Например, энергии, высвобождаемой при образовании двух дополнительных связей Pb-X (где X представляет собой H, Cl или что-то еще), может быть недостаточно для компенсации дополнительной энергии, необходимой для продвижения 6s-электрона на пустую 6p-орбиталь. Это, конечно, было бы еще хуже, если бы энергетический зазор между 6s- и 6p-орбиталями увеличивался за счет релятивистского сжатия 6s-орбитали.
В меню группы 4 . . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2004 г. (последнее изменение: январь 2022 г.) | ||
Тенденции состояния окисления в группе 4
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3691
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице рассматриваются степени окисления (степени окисления), принятые элементами группы 4 (углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb)). Он исследует растущую тенденцию элементов к образованию соединений со степенью окисления +2, особенно для олова и свинца.
Некоторые примеры тенденций изменения степеней окисления
Типичная степень окисления элементов группы 4 равна +4, например, CCl 4 , SiCl 4 и SnO 2 .
CH 4 , однако, не является примером углерода со степенью окисления +4. Поскольку углерод более электроотрицателен, чем водород, его степень окисления равна -4.
Однако ниже по группе есть еще примеры со степенью окисления +2, такие как SnCl 2 , PbO и Pb 2 + . Состояние +4 олова все еще более стабильно, чем его состояние +2, но для свинца и более тяжелых элементов состояние +2 более стабильно; он доминирует в химии свинца.
Пример из химии углерода
Единственным распространенным примером углерода в степени окисления +2 является окись углерода, CO. Окись углерода является сильным восстановителем, поскольку она легко окисляется до двуокиси углерода, которая имеет более термодинамически стабильное окисление состояние +4. Например, монооксид углерода восстанавливает многие оксиды горячих металлов до простых металлов; эта реакция имеет много полезных применений, одно из которых — извлечение железа в доменной печи.
Например, монооксид углерода восстанавливает многие оксиды горячих металлов до простых металлов; эта реакция имеет много полезных применений, одно из которых — извлечение железа в доменной печи.
Примеры из химии олова
Для олова и ниже состояние +2 становится все более распространенным, и существует множество соединений олова (II) и олова (IV). Однако олово (IV) является более стабильной степенью окисления; поэтому довольно легко превратить соединения олова (II) в соединения олова (IV). Лучше всего это видно на примере того, что ионы Sn 2 + в растворе являются сильными восстановителями.
Раствор, содержащий ионы олова (II) (например, сольватированный хлорид олова (II)), восстанавливает йод до иодид-ионов. При этом ионы олова (II) окисляются до ионов олова (IV).
Ионы олова(II) также восстанавливают ионы железа(III) до ионов железа(II): хлорид олова(II) восстанавливает хлорид железа(III) до хлорида железа(II) в растворе. При этом ионы олова (II) окисляются до более стабильных ионов олова (IV).
При этом ионы олова (II) окисляются до более стабильных ионов олова (IV).
Кроме того, ионы олова(II) легко окисляются сильными окислителями, такими как подкисленный манганат калия(VII) (перманганат калия). Эта реакция используется для титрования определения концентрации ионов олова (II) в растворе.
В качестве последнего примера в органической химии олово и концентрированная соляная кислота традиционно используются для восстановления нитробензола до фениламина (анилина). Олово сначала окисляется до ионов олова (II), а затем до предпочтительных ионов олова (IV).
Примеры из химии свинца
Со свинцом ситуация обратная. Степень окисления свинца (II) более стабильна; соединения свинца (IV) имеют сильную склонность реагировать с образованием соединений свинца (II). Хлорид свинца (IV), например, разлагается при комнатной температуре с образованием хлорида свинца (II) и газообразного хлора:
Оксид свинца(IV) разлагается при нагревании с образованием оксида свинца(II) и кислорода:
Оксид свинца(IV) также реагирует с концентрированной соляной кислотой, окисляя ионы хлорида в кислоте до газообразного хлора. Опять же, свинец уменьшается с +4 до более стабильного состояния +2.
Опять же, свинец уменьшается с +4 до более стабильного состояния +2.
Объяснение трендов степеней окисления
Нет ничего необычного в стабильности степени окисления +4 в группе 4. Каждый из элементов в группе имеет внешнюю электронную структуру ns 2 np x 1 np y 1 , где n — номер периода, варьирующийся от 2 (для углерода) до 6 (для свинца). В степени окисления +4 все валентные электроны непосредственно участвуют в связывании.
Ближе к концу группы наблюдается тенденция к тому, что пара s 2 не участвует в связывании. Это часто известно как эффект инертной пары , и он преобладает в химии свинца. Этому есть два разных объяснения, в зависимости от того, идет ли речь об образовании ионных или ковалентных связей.
Эффект инертной пары при образовании ионных связей
Если элементы группы 4 образуют ионы 2+, они теряют свои p-электроны, оставляя пару s 2 неиспользованной. Например, для образования иона свинца (II) свинец теряет два 6p-электрона, но 6s-электроны остаются неизменными, образуя «инертную пару».
Например, для образования иона свинца (II) свинец теряет два 6p-электрона, но 6s-электроны остаются неизменными, образуя «инертную пару».
Энергии ионизации обычно уменьшаются по группе по мере удаления электронов от ядра. Это не относится к группе 4. Эта первая диаграмма показывает, как общая энергия ионизации, необходимая для образования иона 2+, изменяется в группе. Значения даны в кДж моль -1 .
Обратите внимание на небольшое увеличение между оловом и свинцом. Это указывает на то, что удалить р-электроны из свинца труднее, чем из олова.
Однако при рассмотрении картины потери всех четырех электронов на приведенной ниже диаграмме это несоответствие между оловом и свинцом становится гораздо более очевидным. Относительно большое увеличение между оловом и свинцом связано с большей трудностью удаления пары 6s 2 в свинце, чем соответствующих 5s 2 пара из жести.
(Опять же, все значения даны в кДж·моль -1 , и обе диаграммы имеют приблизительно одинаковый масштаб. )
)
Эти эффекты обусловлены теорией относительности. Более тяжелые элементы, такие как свинец, испытывают релятивистское сжатие электронов, которое притягивает электроны ближе к ядру, чем ожидалось. Поскольку они расположены ближе, их труднее удалить. Чем тяжелее элемент, тем сильнее становится этот эффект. Это влияет на s-электроны в большей степени, чем на p-электроны.
В свинце из-за релятивистского сжатия удалить 6s-электроны энергетически труднее, чем ожидалось. Условия высвобождения энергии при образовании ионов (например, энтальпия решетки или энтальпия гидратации) не могут компенсировать эту дополнительную энергию. Поэтому для свинца не имеет энергетического смысла образовывать ионы 4+.
Эффект инертной пары при образовании ковалентных связей
Углерод обычно образует четыре ковалентные связи, а не две. Используя обозначение электронов в ящиках, внешняя электронная структура углерода выглядит следующим образом:
Есть только два неспаренных электрона. Однако прежде чем углерод образует связи, он обычно переводит s-электрон на пустую р-орбиталь.
Однако прежде чем углерод образует связи, он обычно переводит s-электрон на пустую р-орбиталь.
Остаются 4 неспаренных электрона, которые (после гибридизации) могут образовывать 4 ковалентные связи.
Стоит поставлять энергию для продвижения s-электрона, потому что тогда углерод может образовывать в два раза больше ковалентных связей. Каждая образующаяся ковалентная связь высвобождает энергию, и этого более чем достаточно для обеспечения энергии, необходимой для продвижения.
Одно из возможных объяснений нежелания свинца делать то же самое заключается в уменьшении энергии связи вниз по группе. Энергии связи уменьшаются по мере того, как атомы становятся больше, а связывающая пара находится дальше от двух ядер и лучше экранируется от них.
Например, энергии, высвобождаемой при образовании двух дополнительных связей Pb-X (где X представляет собой H или Cl или что-то еще), может быть недостаточно для компенсации дополнительной энергии, необходимой для продвижения 6s-электрона на пустую 6p-орбиталь. Этот эффект усиливается, если энергетический зазор между 6s- и 6p-орбиталями увеличивается за счет релятивистского сжатия 6s-орбитали.
Этот эффект усиливается, если энергетический зазор между 6s- и 6p-орбиталями увеличивается за счет релятивистского сжатия 6s-орбитали.
Авторы и ссылки
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Тенденции состояния окисления в группе 4» распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу Содержание
- нет на странице
- Теги
- химия углерода
- ковалентные связи
- группа 4
- инертная пара
- эффект инертной пары
- ионные связи
- свинец
- химия свинца
- окисление
- степень окисления
- степени окисления
- олово
- химия олова
- Тренды
кремний | Элемент, атом, свойства, использование и факты
кремний
Посмотреть все носители
- Ключевые люди:
- Йонс Якоб Берцелиус Фредерик Марк Бекет
- Связанные темы:
- кремниевый детектор реконструкция поверхности аморфный кремний кремний-29 кремний-28
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
кремний (Si) , неметаллический химический элемент из семейства углерода (группа 14 [IVa] периодической таблицы). Кремний составляет 27,7% земной коры; это второй по распространенности элемент в земной коре, уступающий только кислороду.
Кремний составляет 27,7% земной коры; это второй по распространенности элемент в земной коре, уступающий только кислороду.
Название кремний происходит от латинского silex или silicis , что означает «кремень» или «твердый камень». Аморфный элементный кремний был впервые выделен и описан как элемент в 1824 году шведским химиком Йонсом Якобом Берцелиусом. Нечистый кремний был получен уже в 1811 году. Кристаллический элементарный кремний не был получен до 1854 года, когда он был получен в виде продукта электролиза. Однако в форме горного хрусталя кремний был знаком додинастическим египтянам, которые использовали его для изготовления бус и маленьких ваз; к ранним китайцам; и, вероятно, многим другим древним. Изготовлением стекла, содержащего кварц, занимались как египтяне — по крайней мере, уже в 1500 г. до н. э., так и финикийцы. Конечно, многие из встречающихся в природе соединений, называемых силикатами, использовались в различных видах строительных растворов для строительства жилищ самыми ранними людьми.
| atomic number | 14 |
|---|---|
| atomic weight | 28.086 |
| melting point | 1,410 °C (2,570 °F) |
| boiling point | 3,265 ° C (5909 °F) |
| плотность | 2,33 г/см 3 |
| степень окисления | −4, (+2), +4 | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2 |
Occurrence and distribution
On a по массе содержание кремния в земной коре уступает только кислороду. Оценки космического содержания других элементов часто приводятся в терминах числа их атомов, приходящихся на 10 6 атомов кремния. Только водород, гелий, кислород, неон, азот и углерод превосходят кремний по космическому изобилию. Кремний считается космическим продуктом поглощения альфа-частиц при температуре около 10 9 К, по ядрам углерода-12, кислорода-16 и неона-20. Энергия, связывающая частицы, образующие ядро кремния, составляет около 8,4 миллиона электрон-вольт (МэВ) на нуклон (протон или нейтрон). По сравнению с максимумом около 8,7 млн электрон-вольт для ядра железа, почти в два раза более массивного, чем у кремния, эта цифра указывает на относительную стабильность ядра кремния.
Только водород, гелий, кислород, неон, азот и углерод превосходят кремний по космическому изобилию. Кремний считается космическим продуктом поглощения альфа-частиц при температуре около 10 9 К, по ядрам углерода-12, кислорода-16 и неона-20. Энергия, связывающая частицы, образующие ядро кремния, составляет около 8,4 миллиона электрон-вольт (МэВ) на нуклон (протон или нейтрон). По сравнению с максимумом около 8,7 млн электрон-вольт для ядра железа, почти в два раза более массивного, чем у кремния, эта цифра указывает на относительную стабильность ядра кремния.
Чистый кремний слишком реакционноспособен, чтобы его можно было найти в природе, но он встречается практически во всех горных породах, а также в песке, глинах и почвах в сочетании с кислородом в виде кремнезема (SiO 2 , диоксид кремния) или с кислородом и другими элементами (например, алюминием, магнием, кальцием, натрием, калием или железом) в виде силикатов. Окисленная форма, такая как двуокись кремния и особенно силикаты, также распространена в земной коре и является важным компонентом мантии Земли. Его соединения встречаются также во всех природных водах, в атмосфере (в виде кремнеземистой пыли), во многих растениях, в скелетах, тканях и биологических жидкостях некоторых животных.
Его соединения встречаются также во всех природных водах, в атмосфере (в виде кремнеземистой пыли), во многих растениях, в скелетах, тканях и биологических жидкостях некоторых животных.
Британская викторина
118 Названия и символы Периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
В соединениях диоксид кремния встречается как в кристаллических минералах (например, кварц, кристобалит, тридимит), так и в аморфных или кажущихся аморфными минералах (например, агат, опал, халцедон) во всех районах суши. Природные силикаты характеризуются обилием, широким распространением, сложностью строения и состава. В силикатных минералах содержится большинство элементов следующих групп периодической таблицы: группы 1–6, 13 и 17 (I–IIIa, IIIb–VIb, VIIa). Эти элементы считаются литофильными или камнелюбивыми. Важные силикатные минералы включают глины, полевой шпат, оливин, пироксен, амфиболы, слюды и цеолиты.
Эти элементы считаются литофильными или камнелюбивыми. Важные силикатные минералы включают глины, полевой шпат, оливин, пироксен, амфиболы, слюды и цеолиты.
Свойства элемента
Элементарный кремний получают в промышленных масштабах путем восстановления кремнезема (SiO 2 ) коксом в электрической печи, а затем очищенный продукт очищают. В небольших масштабах кремний можно получить из оксида восстановлением алюминием. Почти чистый кремний получают восстановлением тетрахлорида кремния или трихлорсилана. Для использования в электронных устройствах монокристаллы выращивают путем медленного извлечения затравочных кристаллов из расплавленного кремния.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Чистый кремний представляет собой твердое вещество темно-серого цвета с металлическим блеском и октаэдрической кристаллической структурой, такой же, как у алмазной формы углерода, с которой кремний имеет много химических и физических сходств. Пониженная энергия связи в кристаллическом кремнии делает этот элемент менее плавящимся, более мягким и химически более активным, чем алмаз. Описана коричневая порошкообразная аморфная форма кремния, которая также имеет микрокристаллическую структуру.
Пониженная энергия связи в кристаллическом кремнии делает этот элемент менее плавящимся, более мягким и химически более активным, чем алмаз. Описана коричневая порошкообразная аморфная форма кремния, которая также имеет микрокристаллическую структуру.
Поскольку кремний образует цепочки, подобные тем, которые образованы углеродом, кремний изучался как возможный базовый элемент для кремниевых организмов. Однако ограниченное число атомов кремния, которые могут образовывать катеты, значительно уменьшает количество и разнообразие соединений кремния по сравнению с соединениями углерода. Окислительно-восстановительные реакции необратимы при обычных температурах. В водных системах стабильны только степени окисления 0 и +4 кремния.
Кремний, как и углерод, относительно неактивен при обычных температурах; но при нагревании он энергично реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и с некоторыми металлами с образованием силицидов. Как и в случае с углеродом, связи в элементарном кремнии достаточно прочны, чтобы требовать больших энергий для активации или стимулирования реакции в кислой среде, поэтому на него не действуют кислоты, кроме плавиковой. При красном калении кремний подвергается воздействию водяного пара или кислорода, образуя поверхностный слой диоксида кремния. Когда кремний и углерод объединяются при температуре электропечи (2000–2600 ° C [3600–4700 ° F]), они образуют карбид кремния (карборунд, SiC), который является важным абразивом. С водородом кремний образует ряд гидридов, силанов. В сочетании с углеводородными группами кремний образует ряд кремнийорганических соединений.
При красном калении кремний подвергается воздействию водяного пара или кислорода, образуя поверхностный слой диоксида кремния. Когда кремний и углерод объединяются при температуре электропечи (2000–2600 ° C [3600–4700 ° F]), они образуют карбид кремния (карборунд, SiC), который является важным абразивом. С водородом кремний образует ряд гидридов, силанов. В сочетании с углеводородными группами кремний образует ряд кремнийорганических соединений.
Известны три стабильных изотопа кремния: кремний-28, составляющий 92,21% элемента в природе; кремний-29, 4,70%; и кремний-30, 3,09%. Известно пять радиоактивных изотопов.
Элементарный кремний и большинство кремнийсодержащих соединений нетоксичны. Действительно, ткани человека часто содержат от 6 до 90 миллиграммов кремнезема (SiO 2 ) на 100 граммов сухого веса, и многие растения и низшие формы жизни усваивают кремнезем и используют его в своих структурах. Вдыхание пыли, содержащей альфа-SiO 2 , однако, вызывает серьезное заболевание легких, называемое силикозом, распространенное среди шахтеров, каменотесов и керамистов, если не используются защитные устройства.
100 нано-историй: кремний против кремния + окисление кремния! | Карлос Мануэль Харкин Санчес
Эпизод #80: Все о кремнеземе!
Это ваш любимый энтузиаст материаловедения и нанотехнологий! Сегодня я расскажу больше об атоме кремнезема и о том, как рассчитать степень окисления (чтобы объяснить, почему диоксид кремния является такой замечательной молекулой для аэрогелей кремнезема).0008
Для краткого обзора того, что такое Оксидация, я рекомендую прочитать статью ниже:
100 Нано-Историй: Оксидация!
Эпизод #54: Объяснение состояний окисления углерода!
cjarquin.medium.com
TL;DR → Окисление! 🔑
- Окисление означает количество электронов атома в химическом соединении, которое было потеряно или получено в результате процесса, известного как окисление. Это число известно как число окисления !
- Числа окисления могут выглядеть так: (-2, +2, +4)
- Если атом имеет отрицательное число, это означает, что элемент получил электроны от другого элемента.

- Если элемент имеет положительное число, это означает, что элемент потерял электроны от другого элемента.
- Чтобы рассчитать степень окисления любой органической молекулы/соединения, нужно найти количество валентных электронов основного элемента за вычетом валентных электронов от других атомов, присоединенных к этому основному элементу (на приведенной диаграмме).
- Валентные электроны — это электроны во внешней оболочке/последнем ряду атома.
Теперь, когда мы разобрались с основными понятиями, давайте сначала разберемся с оставшейся разницей между Silica, и Silicon!
Сходства и различия! 🔑
Сразу скажу, Кремний — это элемент Периодической таблицы элементов.
Диоксид кремния/диоксид кремния состоит из атомов кремния и кислорода (основным соединением является SiO2.)
Диоксид кремния имеет более высокую температуру плавления и кипения, чем диоксид кремния, потому что существует больше ковалентных связей, которые удерживают молекулу вместе, чем в атоме кремния. Чем больше ковалентных связей, тем выше должна быть температура, чтобы разорвать внутримолекулярные связи.
Чем больше ковалентных связей, тем выше должна быть температура, чтобы разорвать внутримолекулярные связи.
Температура плавления кремния → 1414 °C (2577,2 °F)
Температура плавления кремния → 1713 °C (3115,4 °F)
Температура кипения кремния → 3265 °C (5909 °F)
Температура кипения Силикагель → 2230°C (4046°F)
В диоксиде кремния/диоксиде кремния все степени окисления будут равны нулю, так как диоксид кремния является стабильным и нейтральным соединением.
Но чтобы решить окисление кремнезема, вот как выглядит соединение кремнезема:
Основным элементом на диаграмме является атом кремния , который имеет два атома кислорода, которые связаны двойной связью с атомом кремния. .
Степень окисления кислорода -2, так как количество валентных электронов во внешней оболочке кислорода равно 6, и нужно добавить еще 2 электрона, чтобы «удовлетворить» внешнюю оболочку кислорода.
Нормальная степень окисления атома кремния 0, , но это не работает, потому что нам нужно, чтобы степени окисления в соединении были равны 0.
Итак, мы можем рассчитать степень окисления кремния в кремнеземе, умножив степени окисления обоих атомов кислорода на (- 2 х 2 = -4). -4 — это степень окисления для обоих атомов кислорода, что дает нам следующий вывод:
- Чтобы степени окисления диоксида кремния были равны нулю, атом кремния должен иметь степень окисления +4.
- A “ -4 ” степень окисления от обоих атомов кислорода и “+4” степень окисления равна нулю от общей степени окисления кремния!
Теперь это должно дать нам лучшее объяснение того, почему диоксид кремния/диоксид кремния является таким ценным соединением при изготовлении аэрогелей на основе диоксида кремния и почему он используется во многих областях (например, в аэрогелях).
Я расскажу последние разделы об оптических свойствах кремнеземного аэрогеля в последних эпизодах (Эпизоды № 81– № 85), прежде чем вернуться к сочетанию химии и математики в аэрогелях, прежде чем объявить об идее, которую я хотел бы изучить подробнее!
До скорой встречи с оптическими свойствами кремнеземных аэрогелей для применения в солнечной энергетике! ✌🏽
Окисление → Число электронов атома в химическом соединении, которое было потеряно или получено в результате процесса, известного как окисление. Это число известно как Число окисления!
Это число известно как Число окисления!
Ковалентные связи → Они связаны химически, потому что электроны распределены поровну! Ковалентные связи образуются между двумя неметаллами! Делиться заботой! 😄
Валентные электроны → Электроны во внешней оболочке/последнем ряду атома.
Диоксид кремния/диоксид кремния → Соединение, состоящее из атомов кремния и кислорода (основным соединением является SiO2.)
Почему диоксид кремния имеет более высокую температуру плавления, чем сера?
Диоксид кремния (SiO2) имеет макромолекулярную структуру. Это означает, что он образует тысячи ковалентных связей между своими…
www.mytutor.co.uk
100 Nano-Stories: «В закладках!» 🔖
Все статьи в одном месте!
cjarquin.medium.com
© 2021, Карлос Мануэль Харкин Санчес. Все права защищены.
Сверхчистые наночастицы кремния, синтезированные лазером, с различными степенями окисления для биомедицинских применений
Сверхчистые лазерно-синтезированные наночастицы кремния с переменной степенью окисления для биомедицинских применений
Ахмед
Аль-Каттан, и Юрий В. Рябчиков, аб Тарек
Баати, cd Владимир
Красная, и Хуан Ф.
Санчес-Ройо, и Марк
Сентис, или Диана
Брагер, cg Виктор Ю.
Тимошенко, бфх Мари-Энн
Эстев cg а также
Андрей В.
Кабашин* ах
Рябчиков, аб Тарек
Баати, cd Владимир
Красная, и Хуан Ф.
Санчес-Ройо, и Марк
Сентис, или Диана
Брагер, cg Виктор Ю.
Тимошенко, бфх Мари-Энн
Эстев cg а также
Андрей В.
Кабашин* ах
Принадлежности автора
* Соответствующие авторы
и Экс-Марсельский университет, CNRS, LP3 UMR 7341, Campus de Luminy, Case 917, Marseille cedex 9, Франция
Электронная почта: kabashin@lp3. univ-mrs.fr
univ-mrs.fr
б П.Н. Лебедева РАН, Ленинский проспект, 53, Москва, Россия
в Экс-Марсельский университет, INSERM, CRO2 UMR 911, Faculté de Pharmacie, Марсель Седекс 5, Франция
д Laboratoire des Substances Naturelles, Национальный институт физико-химических исследований и анализа (INRAP), технополь Сиди Табет Ариана 2020, Тунис
и UMDO – Unidad Asociada a CSIC-IMM, Instituto de Ciencias de los Materiales, Universidad de Valencia, PO Box 22085, 46071 Валенсия, Испания
ф Национальный исследовательский ядерный университет «МИФИ» (Московский инженерно-физический институт), Инженерно-физический институт биомедицины (ФизБио), Лаборатория бионанофотоники, Каширское ш. , 31, 115409 Москва, Россия
, 31, 115409 Москва, Россия
г Assistance Publique – Hôpitaux de Marseille, Hôpital Timone, Marseille cedex 5, Франция
ч Московский государственный университет им. М. В. Ломоносова, физфак, 119992 Москва, Россия
Аннотация
rsc.org/schema/rscart38″> Мы используем метод фемтосекундной лазерной фрагментации предварительно приготовленных водно-дисперсных микроколлоидов для изготовления водных растворов сверхчистых наночастиц на основе чистого кремния (Si-NPs) и оцениваем их потенциал для биомедицинских приложений. Наночастицы кажутся сферическими по форме, с низкой дисперсией по размерам и контролируемым средним размером от нескольких нанометров до нескольких десятков нанометров, в то время как отрицательный поверхностный заряд (-35 мВ ± 0,10 в соответствии с z -потенциальные данные) обеспечивает хорошую электростатическую стабилизацию коллоидных растворов Si-NP. Структурный анализ показывает, что НЧ Si состоят из нанокристаллов Si с включениями оксидов кремния, покрытых оболочкой SiO x (1 < x < 2), а общее содержание оксида зависит от фрагментацию проводят в обычной насыщенной кислородом воде (кислородные условия) или в воде, деоксигенированной за счет прокачки инертными газами (Ag или He) до и во время эксперимента (бескислородные условия). Наши тесты на растворение показывают отличную растворимость в воде всех НЧ, в то время как более окисленные НЧ демонстрируют гораздо более быструю кинетику растворения, что объясняется вызванными окислением дефектами в ядре Si-НЧ. Наконец, исследуя взаимодействие НЧ с клетками человека после 72 ч инкубации в различных концентрациях, мы сообщаем об отсутствии каких-либо побочных эффектов НЧ вплоть до высоких концентраций (50 мкг мл -1 ) и хорошая интернализация NP через классический механизм эндоцитоза. Обладая гораздо более высокой чистотой по сравнению с их химически синтезированными аналогами и предоставляя различные визуализирующие и терапевтические функции, лазерно-синтезированные Si-NP перспективны для безопасного и эффективного применения в наномедицине.
Наши тесты на растворение показывают отличную растворимость в воде всех НЧ, в то время как более окисленные НЧ демонстрируют гораздо более быструю кинетику растворения, что объясняется вызванными окислением дефектами в ядре Si-НЧ. Наконец, исследуя взаимодействие НЧ с клетками человека после 72 ч инкубации в различных концентрациях, мы сообщаем об отсутствии каких-либо побочных эффектов НЧ вплоть до высоких концентраций (50 мкг мл -1 ) и хорошая интернализация NP через классический механизм эндоцитоза. Обладая гораздо более высокой чистотой по сравнению с их химически синтезированными аналогами и предоставляя различные визуализирующие и терапевтические функции, лазерно-синтезированные Si-NP перспективны для безопасного и эффективного применения в наномедицине.Число окисления элементов в периодической таблице
Некоторые элементы периодической таблицы имеют только одну или две степени окисления. Но некоторые из них имеют много степеней окисления.
Степень окисления элемента в соединении может быть положительной, отрицательной или равной нулю.
Но некоторые из них имеют много степеней окисления.
Степень окисления элемента в соединении может быть положительной, отрицательной или равной нулю.
В соединениях натрия натрий имеет степень окисления только +1.
Но некоторые типы атомов, такие как хлор, образуют различные степени окисления, такие как -1, 0, +1, +3, +5, +7 в соединениях.
В этом уроке мы обсудим некоторые важные факты о степенях окисления и степенях окисления в периодической таблице, включая блок s, блок p и блок d.
Важные факты о степенях окисления
В этой главе мы обсудим очень важные факты о степенях окисления на примерах с различными соединениями.
Степень окисления может быть положительной или отрицательной
- Мы знаем, что металлов выделяют электроны с образованием положительных ионов. Поэтому металлы всегда образуют положительных степеней окисления.
- Но неметаллы , такие как сера, фосфор, хлор, могут показывать оба положительные или отрицательные степени окисления.

Более одной степени окисления элемента
Некоторые элементы могут иметь более одной степени окисления. Специально d блочные элементы показывают это поведение.
Примеры более чем одной степени окисления элемента
- Хлор: -1, 0, +1, +3, +5, +7
- Марганец: 0, +2, +4, +7
Когда элемент не соединяется или не образует соединения
Когда элемент не соединяется, его степень окисления равна 0.
Пример: степень окисления Au равна 0.
Когда элемент соединяется с элементом того же типа.
Когда элемент объединяется с элементом того же типа, его степень окисления становится равной 0.
Пример: степень окисления Br в Br 2 равна 0.
Степени окисления s-блока
- Все щелочные металлы показывают только +1 степень окисления.
- Все щелочноземельные металлы имеют степень окисления только +2.
Обычно щелочные металлы и щелочноземельные металлы выходят в виде соединений (NaCl, CaCO 3 ). Поэтому мы не можем рассматривать их как свободные элементы.
Поэтому мы не можем рассматривать их как свободные элементы.
Степени окисления элементов p-блока
Некоторые элементы p-блока имеют много степеней окисления, например, хлор (-1, 0, +1, +3, +5, +7) и сера (-2, 0, + 4, +6). Некоторые из них имеют ограниченную степень окисления, например фтор (-1).
Периодическая таблица со степенями окисления
Здесь мы собираемся суммировать степени окисления всех элементов периодической таблицы в одну группу.
ПРИМЕЧАНИЕ.
0013

Водород
Водород образует три степени окисления: -1, 0, +1. Степень окисления 0 происходит только в молекуле водорода.
-1 степень окисления — Примеры
Когда водород образует соединения с металлами, степень окисления водорода равна -1. NaH и CaH 2 вот несколько примеров.
+1 степень окисления
Когда углерод образует соединения с неметаллическими элементами, степень окисления водорода в большинстве случаев становится +1.
- Метан: CH 4 — Электроотрицательность углерода выше, чем у водорода. Так водород окисляется и степень окисления +1.
Щелочные металлы — Группа 1
Щелочные металлы (кроме водорода) удалить один электрон с образованием +1 иона. Так что только степень окисления щелочных металлов +1. Так, литий, натрий, калий, рубидий, цезий имеют только одну степень окисления +1.
Щелочноземельные металлы — группа 2
Как и щелочные металлы, щелочноземельные металлы имеют степень окисления только +2. Бериллий, магний, кальций, стронций, барий
имеют степень окисления +2.
Бериллий, магний, кальций, стронций, барий
имеют степень окисления +2.
p Блок
Группа 3
Элементы третьей группы: бор, алюминий, галлий, индий и таллий.
Бор
- +3: BCl 3 , BF 3
Алюминий (алюминий)
Алюминий – это металл. Таким образом, он удаляет свои три электрона из последней оболочки, чтобы показать степень окисления +3. Немного примерами +3 степеней окисления алюминия являются AlCl 3 , Ал 2 О 3 .
Группа 4
Углерод
Степень окисления углерода изменяется от -4 до +4.
- -4: Ch 4 -Метан
- -3: Ch 3 CH 3 -Ethane
- -2: Ch 3 CL
- -1: CL 2 CL
- -1: Clch 2 CL
- -1: CL 2 . Cl
- 0 : CH 2 Cl 2
- +1: CH 3 -CHO — Карбонильный углерод имеет степень окисления +1.

- +2: CHCl 3
- +3: CH 3 -COOH — Атом углерода карбоновой кислоты имеет степень окисления +3.
- +4: CCl 4 , CO 2
Группа 5
Группа 5 включает азот, фосфор, мышьяк, сурьму и висмут. Изменение степени окисления при спуск группы.
Азот
Азот имеет различные степени окисления от -3 до +5.
- -3: Аммиак (NH 3 ), хлорид аммония (NH 4 Cl)
- -1: Гидроксиламин (NH 2 OH)
- 0: Газообразный азот (N 2 )
- +1: Закись азота (N 2 O)
- +2: оксид азота (НО)
- +3: Диназот триоксид (N 2 O 3 )
- +4: азотистый диоксид (NO 2 ), триоксид диазота (N 2 O 4 )
- +5: диазот пентоксид (N 2 O 5 )
Фосфор
Фосфор также имеет различные степени окисления от -3 до +5.
- -3: NA 3 P, CA 3 P 2 , PH 3
- -0: P 8 , P 4
- -+1: H 4 9
- -+1: H 4 9
- -+1: H 4 9
- -+10039. 2
- +3: P 2 O 3 , H 3 PO 3
- +5: H 3 PO 4 , NA 3 3 PO 4 , NA 3 39. 2 О 5
Группа 6
Мы собираемся обсудить степени окисления кислорода и серы в элементах группы 6.
Кислород
Кислород занимает второе место по величине электроотрицательности в периодической таблице. Поэтому в большинстве случаев окисление число кислорода отрицательно. Кислород образует только положительные степени окисления при соединении с фтором.
- +2: In F 2
- 0: Молекула кислорода (O 2 )
- -1: Примером степени окисления -1 является перекись водорода (H 2 O 2 ).

- -2: наиболее распространенная степень окисления кислорода -2. Na 2 O, MgO, H 2 O являются примерами -2 степень окисления кислорода.
Сера
Сера — еще один элемент р-блока, который имеет разные степени окисления.
- -2: Na 2 S, H 2 S
- 0: S 8
- +4: SO 2 , H 2 SO 3
- +6: H 2 SO 4 , BaSO 4
Хлор
Хлор также имеет множество степеней окисления. (от -1 до +7)
- -1: HCl , NaCl
- 0: Cl 2 газ
- +1 : HOCl , NaClO
- +3: NaClO 9059 2 3
- +7: NaClO 4 , HClO 4
3d-металлы
Большинство 3d-металлов имеют переменную степень окисления. Например, железо имеет две степени окисления +2 и +3.
- +2: FeO, FeCl 2
- +3: Fe 2 O 3
Цинк имеет только одну степень окисления +2.
3d metals variable oxidation states
| 3d Metal | Oxidation state |
|---|---|
| Sc | +3 |
| Ti | +2 , +3 ,+4 |
| Va | + 2 , +3 , +4 , +5 |
| Кр | +2 , +3 , +6 |
| Mn | +2 , +4 , +6 , +7 |
| Fe | +2 , +3 |
| Co | 2 , +3 |
| Ni | +2 |
| Cu | +1 , +2 |
| Zn | +2 |
Степень окисления и цвет соединения или раствора Возьмем пример
8 90.
- FeCl2 — зеленый
- FeCl3 — коричневый
Почему хлор имеет более широкий диапазон степеней окисления, чем сера?
Сера и хлор находятся в 6-й и 7-й группах периодической таблицы. Таким образом, у нас есть шесть и семь электронов.
их конечные энергетические уровни соответственно. Эти электроны могут объединяться с кислородом, образуя различные соединения. Некоторые примеры обсуждаются ниже.
Эти электроны могут объединяться с кислородом, образуя различные соединения. Некоторые примеры обсуждаются ниже.
Сера отдает все свои последние шесть электронов, образуя молекулу серной кислоты (степень окисления +6). Хлор может отдать семь электронов, чтобы сделать хлорную кислоту со степенью окисления +7.
Хлор может принять один электрон для образования аниона хлорида (степень окисления -1). Сера может принять два электрона, чтобы сформировать анион сульфида. (степень окисления -2).
Common oxidation states of sulfur
| Common Oxidation State | Example Compound | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| -2 | H 2 S | |||||||||||||
| 0 | Elemental sulfur (S 8 ) | |||||||||||||
| +4 | SO 2 | |||||||||||||
| +6 | SO 3 , H 2 SO 4 | |||||||||||||
| Common Oxidation State | Example Compound | |
|---|---|---|
| -1 | HCl | |
| 0 | Cl 2 | |
| +1 | HOCl | |
| +3 | HCLO 2 | |
| +5 | HCLO 3 | |
| +7 | HCLO 4 | HCLO 4 13 |


 для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2.
для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007. – с. 191 №№ 1, 2. Названия. Электронные формулы. Молярные массы. Структурные формулы. Таблицы степеней окисления и валентности. Изотопы. / / Таблица степеней окисления химических элементов. Максимальная и минимальная степень окисления. Возможные степени окисления химических элементов.
Названия. Электронные формулы. Молярные массы. Структурные формулы. Таблицы степеней окисления и валентности. Изотопы. / / Таблица степеней окисления химических элементов. Максимальная и минимальная степень окисления. Возможные степени окисления химических элементов. Справочно: Электронные формулы атомов химических элементов.
Справочно: Электронные формулы атомов химических элементов.


 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.

 Введите свой запрос:
Введите свой запрос: И. Менделеева, с атомным номером 14.
И. Менделеева, с атомным номером 14.
 0039 4 , SiCl 4 и SnO 2 .
0039 4 , SiCl 4 и SnO 2 .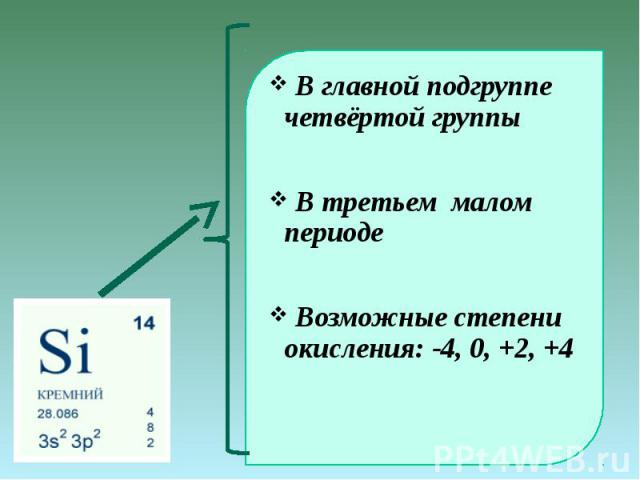
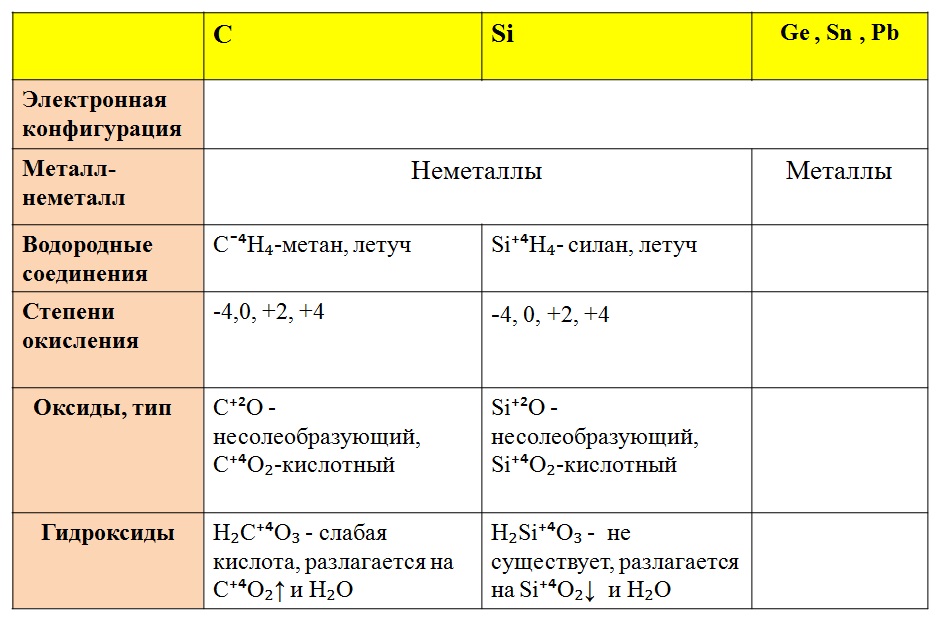 . . а оксид свинца (IV) разлагается при нагревании с образованием оксида свинца (II) и кислорода.
. . а оксид свинца (IV) разлагается при нагревании с образованием оксида свинца (II) и кислорода.