Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
φ°(Mn2+/Mn) = –1,18 В.
Mn + 2h3O = Mn(OH)2 + h3↑.
Mn + 4HNO3 = Mn(NO3)2 + 2NO2↑ + 2h3O.
Э + 7HNO3 = HЭO4 + 7NO2↑ + 3h3O, где Э = Tc, Re.
Соединения марганца(II) MnO, Mn(OH)2 и соли катионного типа
При нагревании:
MnCO3 = MnO + CO2,
MnO + h3O = Mn(OH)2↓,
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4,
2MnSO4 + 2h3O = (MnOH)2SO4 + h3SO4.
Восстановительные свойства:
2Mn(OH)2 + O2 = 2MnO2 + 2h3O,
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7h3O,
3MnSO4 + 2KMnO4 + 2h3O = 5MnO2 + K2SO4 + 2h3SO4.
Mn2O3, слабое основание Mn(OH)3 и соли. Соединения марганца(III) легко диспропорционируют:
Соединения марганца(IV)
MnO2 – чёрно-бурый, Mn(SO4)2, Na2MnO3 (манганит натрия).
Окислительные свойства MnO2:
MnO2 + 4H+ + 2ē = Mn2+ + 2h3O; φ° = 1,23 В.

MnO2 + 4HCl = MnCl2 + Cl2↑ + 2h3O,
MnO2 + 2KBr + h3SO4 = MnSO4 + Br2 + K2SO4 + h3O.
Восстановительные свойства MnO2 (при сплавл.):
Гидролиз:
При сплавлении:
Гидролиз:
Соли марганцовистой кислоты (h3MnO4) – манганаты.
Получение.
При сплавлении:
2KMnO4 + 2KOH + KNO2 = 2K2MnO4 + KNO3 + h3O,
MnSO4 + 4KOH + 2KNO3 = K2MnO4 + 2KNO2 + K2SO4 + 2h3O,
MnSO4 + 2Br2 + 8NaOH = Na2MnO4 + 4NaBr + Na2SO4 + 4h3O.
Диспропорционирование:
Окислительные свойства:
Восстановительные свойства:
Разложение при нагревании (500 °C):
Mn2O7, HMnO4 и её соли перманганаты.
Получение:
2MnSO4 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4 + 7h3O.

2MnSO4 + 5K2S2O8 + 8h3O = 2HMnO4 + 5K2SO4 + 7h3SO4.
2KMnO4 + h3SO4(конц.) = Mn2O7 + K2SO4 + h3O.
Сильные окислители, особенно в кислой среде:
MnO4 — + 2h3O + 3ē = MnO2 + 4OH– ; φ° = +0,60 В;
MnO4 — + ē = MnO4 2- ; φ° = +0,56 В;
MnO4 — + 8H+ + 5 ē = Mn2+ + 4h3O; φ° = +1,51 В.
Окислительные свойства:
2KMnO4 + 6KI + 4h3O = 2MnO2 + 3I2 + 8KOH,
6KMnO4 + KI + 6KOH = 6K2MnO4 + KIO3 + 3h3O,
2KMnO4 + 10KI + 8h3SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8h3O.
Термическое разложение (выше 250 °C):
Водные растворы неустойчивы:
Разложение Mn2O7:
Mn(OH)2, Mn(OH)3, Mn(OH)4, (h3MnO4), HMnO4.
Основные свойства ослабевают, а кислотные свойства усиливаются в ряду выше.
что, как сбалансировать и часто задаваемые вопросы —
By Лубна Хан
Сульфат марганца (MnSO4) представляет собой кислую ионную соль, а HCl (соляная кислота) представляет собой бесцветную кислоту с резким запахом. Рассмотрим подробно реакцию HCl-MnSO4.
Рассмотрим подробно реакцию HCl-MnSO4.
Соляная кислота реагирует с сульфатом марганца по реакции замещения. MnSO4 — неорганическая гигроскопическая соль, которая поглощает влагу из воздуха с образованием гидратов, а HCl — сильная кислота, которая существует как в жидком, так и в парообразном состоянии.
В этой статье будут рассмотрены энтальпия реакции, продукты, молекулярные силы и другие факторы HCl и MnSO.4 реакция в деталях.
Что является продуктом HCl и MnSO
4MnCl2 (дихлорид марганца) и H2SO4 (Серная кислота) образуются при HCl соединяется с MnSO4.
MnSO4 + HCl → MnCl2 + H2SO4
Какой тип реакции HCl + MnSO?
4HCl+MnSO4 реакция является реакцией двойного замещения.
Как сбалансировать HCl + MnSO
4Реакция MnSO4 с HCl уравновешивается с помощью следующих шагов,
MnSO4 + HCl → MnCl2 + H2SO4
- Первым шагом является определение элементов, участвующих в реакции.
 Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
- Перед соединениями добавляются коэффициенты, чтобы сбалансировать количество элементов с обеих сторон. Коэффициент 2 добавляется перед HCl, чтобы сбалансировать H и Cl. Сбалансированное уравнение будет
- MnSO4 + 2HCl → MnCl2 + H2SO4
HCl + MnSO
4 титрованиеHCl нельзя использовать для титрования MnSO.4 так как оба являются сильными кислотами. Также не наблюдается отчетливого изменения окраски реакции.
HCl + MnSO
4 чистое ионное уравнениеЧистое ионное уравнение для MnSO4 + HCl is
MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
Шаги, необходимые для получения чистого ионного уравнения перечислены ниже,
- Уравнение уравновешивается на первом шаге.
 Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано, - MnSO4 + 2HCl → MnCl2 + H2SO4
- Указаны физические состояния веществ.
- MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
- Расщепление сильных электролиты в их ионы. Все соединения, участвующие в этой реакции, являются сильными электролитами.
- Mn2+(водн.) + SO42-(водн.) + 2H+(водн.) + 2Cl–(водн.) → Mn2+(водн.) + 2Cl–(водн.) + 2H+(водн.) + SO42-(Водно)
- Все ионы являются ионами-спектаторами, поэтому чистой реакции нет. Итак, результирующее ионное уравнение для HCl+MnSO4 is счислимый.

- MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
HCl + MnSO
4 сопряженные парыСопряженные кислотно-основные пары образуются из HCl-MnSO4.
- HCl как кислота выделяет H+ и формы Cl– как его сопряженное основание.
- SO42- ион, действующий как основание, занимает H+ образуя сопряженную кислоту ( H2SO4).
HCl и MnSO
4 межмолекулярные силы- Диполь-дипольные взаимодействия. а также Лондон-дисперсионные силы присутствуют как межмолекулярные силы между молекулами HCl .
- MnSO4 показывает ион-дипольные взаимодействия так как это ионная соль.
HCl + MnSO
4 энтальпия реакцииMnSO4+HCl энтальпия реакции составляет -12. 6 кДж/моль. Энтальпия рассчитывается с использованием табличных значений,
6 кДж/моль. Энтальпия рассчитывается с использованием табличных значений,
| Соединения | Энтальпия в кДж/моль |
|---|---|
| MnSO4(водный) | 1118.2 |
| HCl (водн.) | 166.8 |
| MnCl2(Водно) | 555.13 |
| H2SO4(Водно) | 909.27 |
∆Нf° = ∆Нf°(продукты) – ∆Hf°(реагенты)
= 1464.4 – 1451.8 = -12.6 кДж/моль
HCl + MnSO
4 буферный растворMnSO4 + HCl не образует буферный раствор поскольку используемая кислота (HCl) является сильной кислотой, и ее комбинация с солью марганца (MnSO4) не будет сопротивляться изменению pH.
HCl + MnSO
4 полная реакцияMnSO4 + HCl является полной реакцией, так как образующиеся продукты достаточно растворимы и в дальнейшую реакцию не вступают.
HCl + MnSO
4 экзотермическая или эндотермическая реакцияMnSO4+HCl реакция экзотермический так как в ходе реакции выделяется большое количество тепла.
HCl + MnSO
4 окислительно-восстановительная реакцияMnSO4 + Реакция HCl не является окислительно-восстановительной реакцией, поскольку степени окисления элементов не не показывать никаких изменений.
HCl + MnSO
4 реакция осажденияHCl+MnSO4 реакция не дает осадка, так что это не реакция осаждения. Полученные продукты полностью растворимы..
HCl + MnSO
4 обратимая или необратимая реакцияMnSO4 + Реакция HCl является необратимой реакцией, поскольку водород, будучи менее реакционноспособным, не может вытеснить Mn из его соли, что делает обратную реакцию менее возможной.
HCl + MnSO
4 реакция смещенияРеакция MnSO4 + HCl представляет собой реакция двойного замещения. Поскольку марганец более реакционноспособен, он вытесняет водород из HCl и образует MnCl.2 а потом Х+ далее сочетается с SO42- ион с образованием H2SO4.
Заключение
MnSO4 имеет широкое применение в животноводстве и сельском хозяйстве. Марганцевая соль (MnCl2) используется в качестве предшественника для синтеза бесчисленного множества марганцевых соединений.
Какова степень окисления Mn в \[\text{KMn}{{\text{O}}_{4}},\text{ }{{\text{K}}_{2}}\text{ Mn}{{\text{O}}_{4}},\text{MnS}{{\text{O}}_{4}},\text{Mn}{{\text{O}}_{ 2}}\text{ и M}{{\text{n}}_{3}}{{\text{O}}_{4}}\] соответственно: A. +7, +6, +2, +4, \[+\dfrac{8}{3}\]В. +4, +6, +2, +4, \[+\dfrac{8}{3}\]С. +7, +6, +2, +3, \[+\dfrac{8}{3}\]D. Ни один из этих
Ответить
Проверено 230. 3k+ просмотров
3k+ просмотров
Полное пошаговое решение :
— Чтобы определить степень окисления атома, мы будем рассматривать его как «X».
— Таким образом, чтобы рассчитать степень окисления марганца в \[\text{KMn}{{\text{O}}_{4}}\], мы будем рассматривать степень окисления марганца как «X».
— Мы знаем, что степень окисления калия и кислорода +1 и -2.
-Итак, уравнение примет вид:
$\begin{align}
& \text{+1 + x — 8 = 0} \\
& \text{x = +7} \\
\end{align}$
-Следовательно, степень окисления Mn равна +7.
— Аналогично, степень окисления Mn в ${{\text{K}}_{2}}\text{Mn}{{\text{O}}_{4}}$ будет
$\begin {align}
& +2\text{ + x — 8 = 0} \\
& \text{x = +6} \\
\end{align}$
-Значит, степень окисления Mn равна +6
-Теперь степень окисления Mn в $\text{MnS}{{\text{O}}_{4}}$ будет
$\begin{align}
& \text{x + 6 — 8 = 0} \\
& \text{x — 2 = 0} \\
& \text{x = +2} \\
\end{align}$
-Мы знаем, что степень окисления серы в сульфат-ионе равна +6, поэтому мы поставили +6 как степень окисления серы.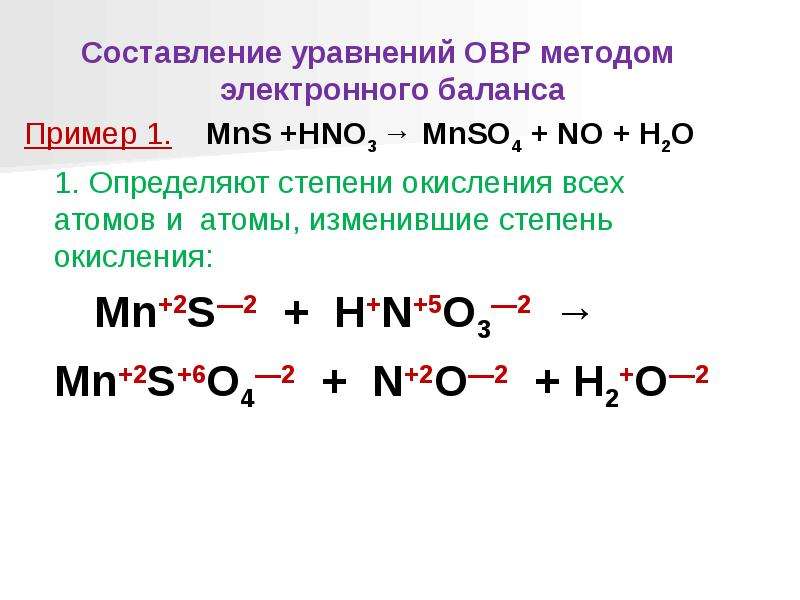
-Значит, степень окисления марганца +2.
— Теперь мы рассчитаем степень окисления Mn в $\text{Mn}{{\text{O}}_{2}}$
$\begin{align}
& \text{x — 4 = 0 } \\
& \text{x = +4} \\
\end{align}$
-Значит, степень окисления Mn равна +2.
-Теперь мы рассчитаем степень окисления Mn в \[\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}\]
\[\begin{align}
& 3\text{x — 8 = 0} \\
& \text{x = +}\dfrac{8}{3} \\
\end{align}\]
-Значит, степень окисления Mn +8/3.
Следовательно, вариант А. является правильным ответом.
Примечание : Перманганат калия относится к категории сильных окислителей. Сера имеет много степеней окисления, таких как -2, 0, +2, +4, +6, и это зависит от связи серы с другими атомами. Как и в сульфате марганца, сера имеет степень окисления +6.
Дата последнего обновления: 13 мая 2023
•
Всего просмотров: 230.3k
•
Просмотров сегодня: 3.92k
Недавно обновленные страницы
900 02 В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_MainЩелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю браков фейерверки 12 класса химии JEE_Main
Щелочные земляные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
900 00 T3DB: Сульфат марганца| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 2. 0 0 | ||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 2009-06-19 21:58:20 UTC | ||||||||||||||||||||||||||||||||||||||||||
| 24-12-2014 20:23:11 UTC | |||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D1131 | ||||||||||||||||||||||||||||||||||||||||||
| Идентификационный номер | Общее название | Сульфат марганца | |||||||||||||||||||||||||||||||||||||||||
| Класс | Малая молекула | ||||||||||||||||||||||||||||||||||||||||||
| Описание | Сульфат марганца представляет собой сульфат марганца. Это предшественник металлического марганца и многих химических соединений, таких как диоксид марганца. Марганец представляет собой встречающийся в природе металл с символом Mn и атомным номером 25. Он не встречается в природе в чистом виде, но встречается во многих типах горных пород в сочетании с другими веществами, такими как кислород, сера или хлор. Марганец содержится в большинстве продуктов питания, и для поддержания здоровья необходимы небольшие количества, так как ионы марганца действуют как кофакторы для ряда ферментов. | ||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||
| Химическая структура | |||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | MnO 4 S | ||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 151,001 г/моль | ||||||||||||||||||||||||||||||||||||||||||
| Масса моноизотопа | 150,890 г/моль | ||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 7785-87-7 | ||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC 9 0109 | сульфат марганца(2+) ион | ||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | сульфат марганца(2+) | ||||||||||||||||||||||||||||||||||||||||||
| SMILES | [Mn++]. | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | 90 114 InChI=1S/Mn .h3O4S/c;1-5(2,3)4/h;(h3,1,2,3,4)/q+2;/p-2|||||||||||||||||||||||||||||||||||||||||||
| Ключ ИнЧИ | ИнЧИКей=SQQMAOCOWKFBNP-UHFFFAOYSA -L | ||||||||||||||||||||||||||||||||||||||||||
| Химическая таксономия | |||||||||||||||||||||||||||||||||||||||||||
| Описание | принадлежит к классу неорганических соединений, известных как сульфаты переходных металлов. Это неорганические соединения, в которых самым большим оксоанионом является сульфат, а самым тяжелым атомом, не входящим в оксоанион, является переходный металл. | ||||||||||||||||||||||||||||||||||||||||||
| Королевство | Неорганические соединения | ||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Смешанные соединения металлов и неметаллов | ||||||||||||||||||||||||||||||||||||||||||
| Класс | 9011 4 Оксоанионные соединения переходных металлов|||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Сульфаты переходных металлов | ||||||||||||||||||||||||||||||||||||||||||
| Прямые исходные вещества | Сульфаты переходных металлов | ||||||||||||||||||||||||||||||||||||||||||
| Альтернативные исходные вещества |
| ||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы |
| ||||||||||||||||||||||||||||||||||||||||||
| Биологические свойства 9 | Статус | Обнаружено и не определено 14
| |||||||||||||||||||||||||||||||||||||||||
| Биофлюиды | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| Ткани | Нет | Пути | Недоступно | ||||||||||||||||||||||||||||||||||||||||
| Приложения | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Биологические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Химические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||
| Состояние | Твердое вещество | ||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | Твердое вещество бледно-красного цвета.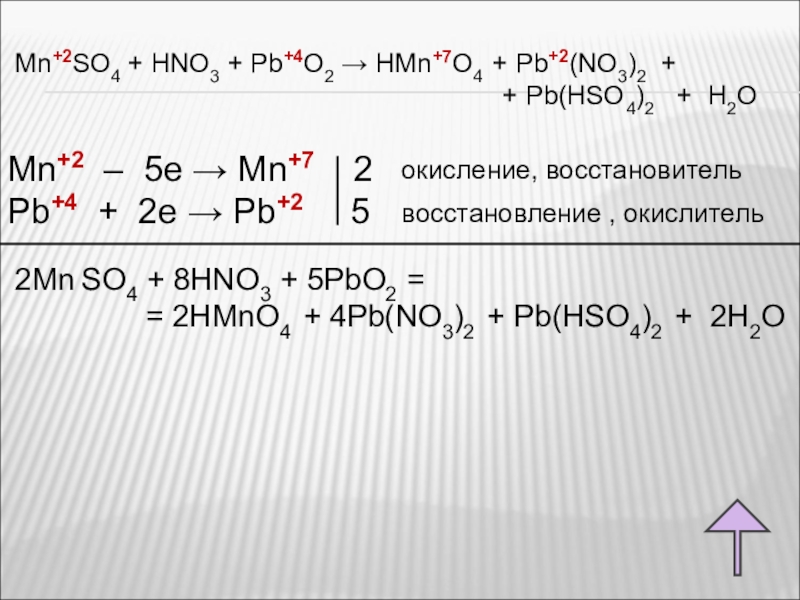 | ||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| ||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства |
| ||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||
| Spectra |
| ||||||||||||||||||||||||||||||||||||||||||
| Профиль токсичности | |||||||||||||||||||||||||||||||||||||||||||
| Путь воздействия | Оральный (3) ; вдыхание (3) | ||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Марганец является клеточным токсикантом, который может нарушать транспортные системы, активность ферментов и функции рецепторов. Он в первую очередь нацелен на центральную нервную систему, особенно на бледный шар базальных ганглиев. Считается, что ион марганца, Mn(II), усиливает самоокисление или обмен различных внутриклеточных катехоламинов, что приводит к увеличению образования свободных радикалов, активных форм кислорода и других цитотоксических метаболитов, наряду с истощением клеточных механизмов антиоксидантной защиты. что приводит к окислительному повреждению и избирательному разрушению дофаминергических нейронов. Считается, что помимо дофамина марганец воздействует на другие нейротрансмиттеры, такие как ГАМК и глутамат. Чтобы вызвать окислительное повреждение, марганец должен сначала подавить антиоксидантный фермент марганцевую супероксиддисмутазу. Нейротоксичность Mn(II) также связана с его способностью замещать Ca(II) в физиологических условиях. Он может проникать в митохондрии через унипортер кальция и ингибировать митохондриальное окислительное фосфорилирование. Он также может ингибировать отток Ca(II), что может привести к потере целостности митохондриальной мембраны. Он в первую очередь нацелен на центральную нервную систему, особенно на бледный шар базальных ганглиев. Считается, что ион марганца, Mn(II), усиливает самоокисление или обмен различных внутриклеточных катехоламинов, что приводит к увеличению образования свободных радикалов, активных форм кислорода и других цитотоксических метаболитов, наряду с истощением клеточных механизмов антиоксидантной защиты. что приводит к окислительному повреждению и избирательному разрушению дофаминергических нейронов. Считается, что помимо дофамина марганец воздействует на другие нейротрансмиттеры, такие как ГАМК и глутамат. Чтобы вызвать окислительное повреждение, марганец должен сначала подавить антиоксидантный фермент марганцевую супероксиддисмутазу. Нейротоксичность Mn(II) также связана с его способностью замещать Ca(II) в физиологических условиях. Он может проникать в митохондрии через унипортер кальция и ингибировать митохондриальное окислительное фосфорилирование. Он также может ингибировать отток Ca(II), что может привести к потере целостности митохондриальной мембраны. | ||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Марганец всасывается главным образом при приеме внутрь, но также может поступать при вдыхании. Он связывается с альфа-2-макроглобулином, альбумином или трансферрином в плазме и распределяется в головном мозге и всех других тканях млекопитающих, хотя имеет тенденцию накапливаться больше в печени, поджелудочной железе и почках. Марганец может существовать в нескольких степенях окисления и, как полагают, претерпевает изменения степени окисления в организме. Степень окисления марганца может влиять на токсикокинетическое поведение тканей и, возможно, на токсичность. Марганец выводится преимущественно с фекалиями. (3) | ||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | LD50: 305 мг/кг (перорально, мышь) (1) LD50: 64 мг/кг (внутрибрюшинно, мышь) (1) LD50: 146 мг/кг (подкожно, мышь) (1) | ||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (Классификация IARC) | Нет указаний на канцерогенность для человека (не указано) от МАИР). | ||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Сульфат марганца является предшественником металлического марганца и многих химических соединений, таких как диоксид марганца. (5) | ||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Хроническое вдыхание: 0,0003 мг/м3 (2) | ||||||||||||||||||||||||||||||||||||||||||
| Влияние на здоровье | Манганец в основном влияет на нервную систему и может вызвать поведенческие изменения и другие эффекты нервной системы, которые включают перемещения, которые могут стать, которые могут стать, которые могут стать перемещениями, которые могут стать перемещениями. медленный и неуклюжий. Эта комбинация симптомов, когда она достаточно тяжелая, называется «манганизмом». (3) | ||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Марганец в основном влияет на нервную систему и может вызывать изменения в поведении и другие эффекты нервной системы, включая движения, которые могут стать медленными и неуклюжими. Эта комбинация симптомов, когда она достаточно тяжелая, называется «манганизмом». (3) (3) | ||||||||||||||||||||||||||||||||||||||||||
| Лечение | ГЛАЗА: промывать открытые глаза в течение нескольких минут под проточной водой. ПРОГЛАТЫВАНИЕ: не вызывать рвоту. Прополоскать рот водой (никогда ничего не давать в рот человеку, находящемуся без сознания). Немедленно обратитесь за медицинской помощью. КОЖА: следует немедленно обработать путем промывания пораженных участков холодной проточной водой в течение не менее 15 минут с последующим тщательным мытьем водой с мылом. При необходимости человек должен принять душ и сменить загрязненную одежду и обувь, а затем обратиться за медицинской помощью. ВДЫХАНИЕ: приток свежего воздуха. При необходимости обеспечить искусственное дыхание. | ||||||||||||||||||||||||||||||||||||||||||
| Нормальные концентрации | |||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||
| Аномальные концентрации | |||||||||||||||||||||||||||||||||||||||||||
| Недоступно 9 0115 | |||||||||||||||||||||||||||||||||||||||||||
| Внешние ссылки | |||||||||||||||||||||||||||||||||||||||||||
| Идентификатор DrugBank | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор HMDB | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения PubChem | 24580 | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор CheMBL | CHEMBL2103742 | ||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 22984 | ||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| UniProt ID | 9011 4 Нет в наличии|||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | |||||||||||||||||||||||||||||||||||||||||||
| ЧЭБИ ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||
| CTD ID | C039798 | ||||||||||||||||||||||||||||||||||||||||||
| ID стежка | Сульфат марганца | ||||||||||||||||||||||||||||||||||||||||||
| Идентификатор PDB | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| ID АКТОРА | 12206 | ||||||||||||||||||||||||||||||||||||||||||
| Ссылка на Википедию | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| Ссылка на синтез | Недоступно | ||||||||||||||||||||||||||||||||||||||||||
| MSDS | T3D1131. | ||||||||||||||||||||||||||||||||||||||||||



 Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O. Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
 0115
0115