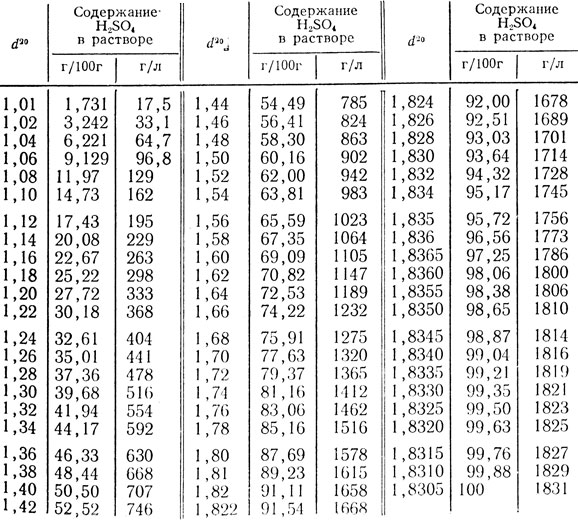
Таблица Плотность растворов кислот, щелочей и солей различных концентраций при 15`С (Винил)
Распродажа со склада Учебно-педагогическая документация Доски школьные Мебель
Учебные пособия и оборудование
- Символика
- Начальная школа
- Кабинет Русского языка и Литературы
- Кабинет Математики
- Кабинет Химии
- Кабинет Физики
- Кабинет Биологии
- Кабинет Иностраных Языков
- Кабинет Истории и Обществознания
- Кабинет Географии
- Кабинет Экологии
- Кабинет Технология
- Кабинет ИЗО
- Кабинет Музыки
- Кабинет Физкультуры
- Кабинет ОБЖ и НВП
- Кабинет информатики
- Кабинет Медицины
- Магнитные учебные пособия
- DVD-диски
- Автошкола и автодром
- Учебные пособия и оборудование
- Кабинет Химии
- Пособия
Таблица Плотность растворов кислот, щелочей и солей различных концентраций при 15`С (Винил)
Обратите внимание! Описание товара Таблица Плотность растворов кислот, щелочей и солей различных концентраций при 15`С (Винил) на нашем сайте носит информационный характер и
может отличаться от описания, представленного в документации производителя .
Растворы. Способы выражения концентрации растворов
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра(0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.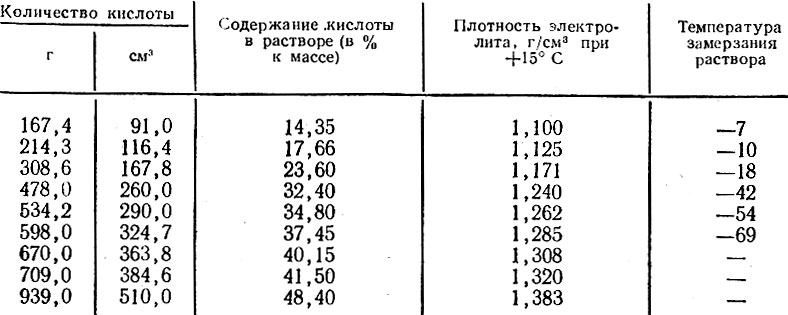
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность С н всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | Сн | Сн | См | |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН) 2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Понравилось это:
Нравится Загрузка…
8.1: Концентрации растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 155677
Результаты обучения
- Определение концентрации.

- Используйте термины «концентрированный» и «разбавленный» для описания относительной концентрации раствора.
- Рассчитайте молярность раствора.
- Расчет процентной концентрации (м/м, об/об, м/об).
- Опишите раствор с концентрацией в \(\text{ppm}\) или \(\text{ppb}\).
- Используйте единицы измерения концентрации в расчетах.
- Определите эквиваленты для иона.
- Завершите расчеты относительно эквивалентов молей, объемов или массы.
- Завершить расчет разбавления.
Существует несколько способов выражения количества растворенного вещества в растворе. Концентрация раствора является мерой количества растворенного вещества, растворенного в данном количестве растворителя или раствора . Концентрированный раствор содержит относительно большое количество растворенного вещества. Разбавленный раствор содержит относительно небольшое количество растворенного вещества . Однако эти термины относительны, и нам нужно уметь выражать концентрацию более точным, количественным образом. Тем не менее, концентрированный и разбавленный полезны как термины для сравнения одного раствора с другим (см. рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что отношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Однако эти термины относительны, и нам нужно уметь выражать концентрацию более точным, количественным образом. Тем не менее, концентрированный и разбавленный полезны как термины для сравнения одного раствора с другим (см. рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что отношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Концентрация в процентах
Одним из способов описания концентрации раствора является процентная доля раствора, состоящего из растворенного вещества. Этот процент может быть определен одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленная на объем раствора, или (3) масса растворенного вещества. растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
Массовый процент
Когда растворенное вещество в растворе является твердым, удобным способом выражения концентрации является массовый процент (масса/масса), который представляет собой граммы растворенного вещества на \(100 \: \text{g} \) решения.
\[\text{Проценты по массе} = \frac{\text{масса растворенного вещества}}{\text{масса раствора}} \times 100\%\]
Предположим, что раствор был приготовлен путем растворения \ (25,0 \: \text{г}\) сахара в \(100 \: \text{г}\) воды. Процент по массе будет рассчитываться следующим образом: 93 \: \text{g} \right)\), чтобы вычислить массу воды, которую необходимо добавить.
Объемный процент
Процентное содержание растворенного вещества в растворе легче определить по объему, когда растворяемое вещество и растворитель оба являются жидкостями. Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
\[\begin{align} \text{Проценты по объему} &= \frac{\text{объем растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{ 40 \: \text{мл этанола}}{240 \: \text{мл раствора}} \times 100\% \\ &= 16,7\% \: \text{этанол} \end{align}\]
Часто , на этикетках ингредиентов пищевых продуктов и лекарств количества указаны в процентах (см. рисунок ниже).
Рисунок \(\PageIndex{2}\): Перекись водорода обычно продается в виде раствора \(3\%\) по объему для использования в качестве дезинфицирующего средства. Следует отметить, что, в отличие от массы, нельзя просто сложить объемы растворенного вещества и растворителя, чтобы получить окончательный объем раствора. При совместном добавлении растворенного вещества и растворителя сохраняется масса, но не объем. В приведенном выше примере раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получилось \(240 \: \text{мл}\) раствора. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
В приведенном выше примере раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получилось \(240 \: \text{мл}\) раствора. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
Массово-объемные проценты также используются в некоторых случаях и рассчитываются аналогично предыдущим двум процентам. Процент массы/объема рассчитывается путем деления массы растворенного вещества на объем раствора и выражения результата в процентах.
Например, если раствор готовится из \(10 \: \ce{NaCl}\) в воде, достаточной для приготовления раствора \(150 \: \text{мл}\), массовая концентрация равна
\[\begin{align} \text{Объемно-массовая концентрация} & \frac{\text{масса растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{10 \: \text{g} \: \ce{NaCl}}{150 \: \text{мл раствора}} \times 100\% \\ &= 6,7\% \end{align}\]
Части на миллион и Части на миллиард
Двумя другими единицами концентрации являются части на миллион и части на миллиард. Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Например, \(32 \: \text{ppm}\) может быть записано как \(\frac{32 \: \text{мг растворенного вещества}}{1 \: \text{L раствор}}\), а \(59 \: \text{ppb}\) можно записать как \(\frac{59 \: \mu \text{g раствор}}{1 \: \text{L раствор}}\).
Молярность
Химикам в первую очередь нужно, чтобы концентрация растворов выражалась таким образом, чтобы учитывать количество присутствующих частиц, которые могут реагировать в соответствии с конкретным химическим уравнением. Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях. молярность \(\left( \text{M} \right)\) раствора — это количество молей растворенного вещества, растворенного в одном литре раствора . Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях. молярность \(\left( \text{M} \right)\) раствора — это количество молей растворенного вещества, растворенного в одном литре раствора . Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
\[\text{Молярность} \: \left( \text{M} \right) = \frac{\text{моли растворенного вещества}}{\text{литры раствора}} = \frac{\text{ mol}}{\text{L}}\]
Обратите внимание, что объем указан в литрах раствора, а не в литрах растворителя. Когда сообщается молярность, единицей измерения является символ \(\text{M}\), который читается как «молярность». Например, раствор, обозначенный как \(1,5 \: \text{M} \: \ce{NH_3}\), представляет собой «1,5 молярный раствор аммиака».
Пример \(\PageIndex{1}\)
Раствор готовят путем растворения \(42,23 \: \text{g}\) \(\ce{NH_4Cl}\) в количестве воды, достаточном для получения \(500,0 \: \text{мл}\) раствора. Вычислите его молярность.
Вычислите его молярность.
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Масса \(\ce{NH_4Cl} = 42,23 \: \text{g}\)
- Молярная масса \(\ce{NH_4Cl} = 53,50 \: \text{г/моль}\)
- Объем раствора \(= 500,0 \: \text{мл} = 0,5000 \: \text{л}\)
Неизвестно
- Молярность \(= ? \: \text{M}\)
Массу хлорида аммония сначала переводят в моли. Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Шаг 2: Решить.
\[42,23 \: \text{g} \: \ce{NH_4Cl} \times \frac{1 \: \text{моль} \: \ce{NH_4Cl}}{53,50 \: \text{g} \: \ce{NH_4Cl}} = 0,7893 \: \text{моль} \: \ce{NH_4Cl}\]
\[\frac{0,7893 \: \text{моль} \: \ce{NH_4Cl}}{0,5000 \: \text{L}} = 1,579 \: \text{M}\]
Шаг 3: Подумайте о своем результате .
Молярность равна \(1,579 \: \text{M}\), что означает, что литр раствора будет содержать 1,579 молей \(\ce{NH_4Cl}\). Уместно наличие четырех значащих цифр.
Уместно наличие четырех значащих цифр.
Разведения
При добавлении дополнительного количества воды к водному раствору концентрация этого раствора уменьшается. Это связано с тем, что количество молей растворенного вещества не меняется, а общий объем раствора увеличивается. Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
\[\text{моль}_1 = \text{моль}_2\]
Поскольку моль растворенного вещества в растворе равна молярности, умноженной на объем в литрах, мы можем установить их равными.
\[M_1 \times L_1 = M_2 \times L_2\]
Наконец, поскольку две части уравнения установлены равными друг другу, объем может быть в любых выбранных нами единицах, если эта единица является одинаково с обеих сторон. Наше уравнение для расчета молярности разбавленного раствора принимает следующий вид:
\[M_1 \times V_1 = M_2 \times V_2\]
Кроме того, концентрация может быть выражена в любых других единицах, если \(M_1\) и \( M_2\) находятся в одном блоке.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \frac{M_1 \times V_1}{V_2} = \frac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl}\]
Раствор разбавлен в пять раз, так как новый объем в пять раз больше исходного. оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения. Другая распространенная проблема разбавления заключается в том, чтобы решить, сколько высококонцентрированного раствора требуется для получения желаемого количества раствора с более низкой концентрацией. Высококонцентрированный раствор обычно называют исходным раствором.
Пример \(\PageIndex{2}\)
Азотная кислота \(\left( \ce{HNO_3} \right)\) является сильной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Запас \(\ce{HNO_3} \:\left( M_1 \right) = 16 \: \text{M}\)
- \(V_2 = 8.00 \: \text{L}\)
- \(М_2 = 0,50 \: \текст{М}\)
Неизвестно
- Объем запаса \(\ce{HNO_3} \: \left( V_1 \right) = ? \: \text{L}\)
Неизвестным в уравнении является \(V_1\), необходимый объем концентрированного маточного раствора.
Шаг 2: Решить.
\[V_1 = \frac{M_2 \times V_2}{V_1} = \frac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M} } = 0,25 \: \text{L} = 250 \: \text{мл}\]
Шаг 3: Подумайте о своем результате.
\(250 \: \text{мл}\) исходного \(\ce{HNO_3}\) раствора необходимо разбавить водой до конечного объема \(8,00 \: \text{л}\ ). Разбавление от \(16 \: \text{M}\) до \(0,5 \: \text{M}\) равно коэффициенту 32.
Разбавление от \(16 \: \text{M}\) до \(0,5 \: \text{M}\) равно коэффициенту 32.
Эквиваленты
много способов. Также очень важно использовать единицы с любыми значениями, чтобы обеспечить правильную дозировку лекарств или сообщать об уровнях веществ в крови, и это только два. 9{2-}} & 2 \end{array}\]
Эквиваленты используются, поскольку концентрация зарядов важнее, чем идентичность растворенных веществ. Например, стандартный раствор для внутривенного введения не содержит тех же растворенных веществ, что и кровь, но концентрация зарядов такая же.
Иногда концентрация ниже, и в этом случае миллиэквиваленты \(\left( \text{mEq} \right)\) являются более подходящей единицей измерения. Так же, как метрические префиксы, используемые с базовыми единицами, милли используются для изменения эквивалентов, поэтому \(1 \: \text{Eq} = 1000 \: \text{mEq}\). 9+}\]
Авторы и авторство
Эта страница под названием 8.1: Concentrations of Solutions распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Включено
- да
- Теги
- концентрация
- частей на миллион
- источник@https://ck12.
 org
org - источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник-хим-58828
Плотность водных растворов неорганических солей натрия
Обратите внимание на единицы концентрации на рисунках:
% масс.: Масса растворенного вещества/общая масса раствора*100%
моль/кг: Моляльность = моль растворенного вещества/кг воды
моль/литр: Молярность = моль растворенного вещества/литр раствора
Значения приведены в таблице под рисунками.
См. также плотность водных растворов неорганических хлоридов, неорганических солей калия, некоторых других неорганических веществ, органических кислот и органических веществ, таких как сахара и спирты.
Плотность водных растворов при 20°C, выраженная в г/см 3 :
Для полной таблицы — повернуть экран!
| % по массе | Ацетат натрия | Бромид натрия | Sodium carbonate | Sodium chloride | Sodium citrate dihydrate | Sodium dihydrogen phosphate | Sodium hydrogen carbonate | Sodium hydrogen phosphate | Sodium hydroxyde | Нитрат натрия | Фосфат натрия | Сульфат натрия | Тиосульфат натрия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1. 0034 0034 | 1.006 | 1.0086 | 1.0053 | 1.0049 | 1.0056 | 1.0054 | 1.0082 | 1.0095 | 1.005 | 1.01 | 1.0071 | 1.0065 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 | 1,0234 | 1,038 | 1,0502 | 1,034 | 1,0331 | 1,04357 | 1.048 | 1.0538 | 1.0322 | 1.0579 | 1.0436 | 1.0399 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10 | 1.0495 | 1.0803 | 1.1029 | 1.0707 | 1.0708 | 1.0747 | 1.1089 | 1.0674 | 1,0905 | 1,0827 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20 | 1,1050 | 1,1745 | 1,1479 9144482 | 1.1576 | 1.2192 | 1.1429 | 1.1907 | 1.174 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 30 | 1.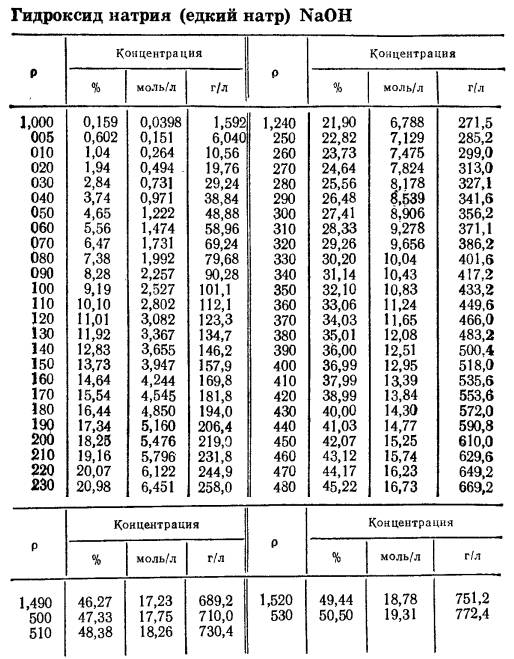 1602 1602 | 1.2842 | 1.2488 | 1.3277 | 1.2256 | 1.2739 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 40 | 1.4138 | 1.3493 | 1.4299 | 1.0449 | 1,3827 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность при 20°C, выраженная в г/см3 Для полной таблицы — повернуть экран!
Перевод концентрации из массовых % в моль/литр (моль растворенного вещества/литр раствора = молярность): Для полной таблицы — поверните экран!
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 org
org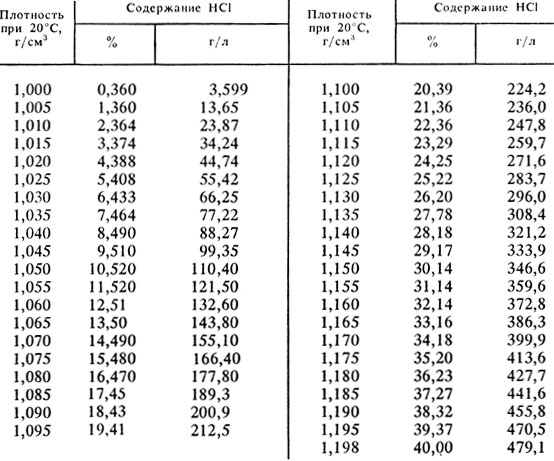 098
098 224
224