Алюминий и его соединения: получение, применение и химические свойства
Запитання 1
Электронная формула внешнего энергетического уровня атома алюминия (в невозбужденном состоянии) – это:
варіанти відповідей
3s2 3p1
3s2 3p3
3s2 3p2
2s2 2p1
Запитання 2
Такое же строение как и у иона Al3+ имеет атом…
варіанти відповідей
…аргона
…гелия
…неона
…криптона
Запитання 3
Установите соответствие:
Формула Название вещества
1. Al2O3 А. Алюминий сульфид
2. Al(OH)3 Б. Алюминий сульфат
3. Al(NO3)3 В. Алюминий гидроксид
4. Al2(SO4)3 Г. Алюминий хлорид
5. Al2S3 Д. Алюминий нитрат
Алюминий нитрат
6. AlCl3 Е. Алюминий оксид
варіанти відповідей
1-Г, 2-Д, 3-Е, 4-В, 5-А, 6-Б
1-В, 2-Е, 3-Г, 4-Д, 5-А, 6-Б
1-Б, 2-Г, 3-А, 4-В, 5-Е, 6-Д
1-Е, 2-В, 3-Д, 4-Б, 5-А, 6-Г
Запитання 4
Установите соответствие:
Схема превращения Тип реакции:
1. Al2O3 + HCl А. реакция замещения
2. Al(OH)3 (t) = Б. реакция соединения
3. Al + I2 В. ОВР
4. Al + KOH + h3O Г. Реакция разложения
5. Al + HCl Д. реакция обмена
варіанти відповідей
1-Д, 2-Г, 3-Б, 4-В, 4-А
1-В, 2-А, 3-Д, 4-Г, 4-Б
1-Д, 2-В, 3-А, 4-Г, 5-Б
1-А, 2-Б, 3-Г, 4-Д, 5-В
Запитання 5
Установите соответствие между схемой превращения и типом химического превращения:
Схема превращения Тип химического превращения (взаимодействия реагентов):
1.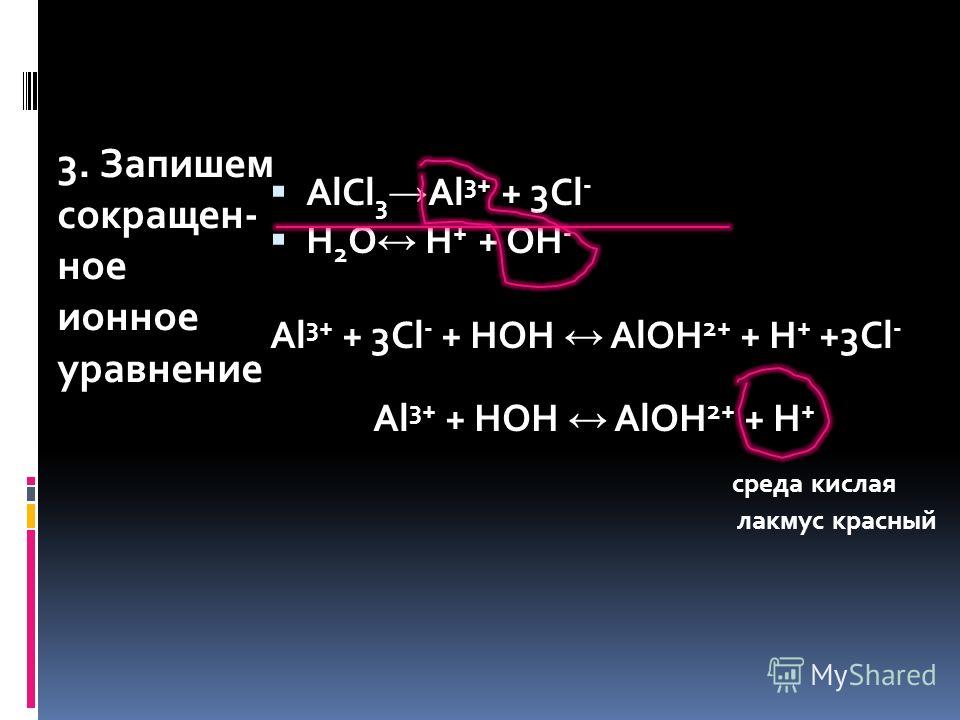 Al(OH)3 + HNO3 А. растворимая соль + растворимое основание
Al(OH)3 + HNO3 А. растворимая соль + растворимое основание
2. Al(OH)3 (t) = Б. взаимодействие двух растворимых солей
3. Al + I2 = В. металл + кислота
4. Al2(SO4)3 + KOH Г. нерастворимое основание + растворимая кислота
5. Al + HCl = Д. термическое разложения нерастворимого основания
6. Al(NO3)3 + Na3PO4 = Е. металл + неметалл
варіанти відповідей
1-Е, 2-Д, 3-А, 4-Г, 5-Б, 6-В
1-Г, 2-Д, 3-Е, 4-А, 5-В, 6-Б
1-Д, 2-Б, 3-А, 4-В, 5-Е, 6-Г
1-Б, 2-Г, 3-В, 4-А, 5-Е, 6-Д
Запитання 6
Установите соответствие между название и её типом:
Название соли Тип соли
1. Na3[Al(OH)6] А. Двойная соль
2. AlCl3 Б. Основная соль
3. Al(h3PO4)3 В. Кислая соль
4. AlOHCl2 Г. Комплексная соль
Комплексная соль
5. K[Al(SO4)2] Д. Средняя соль
варіанти відповідей
1-Б, 2-Г, 3-Д, 4-А, 5-В
1-Д, 2-А, 3-Б, 4-Г, 5-В
1-В, 2-Б, 3-А, 4-Д, 5-Г
1-Г, 2-Д, 3-В, 4-Б, 5-А
Запитання 7
Установите соответствие между формулой вещества и его названием:
Название соли Тип соли
1. Алюминий нитрид А. KAlO2
2. Алюминий карбид Б. K[Al(OH)4]
3. Калий тетрагидроксоалюминат B. Al4C3
4. Калий метаалюминат Г. AlN
варіанти відповідей
1-Б, 2-А, 3-Г, 4-В
1-Г, 2-В, 3-Б, 4-А
1-А, 2-Б, 3-В, 4-Г
1-Г, 2-В, 3-А, 4-Б
Запитання 8
Установите последовательность использованных реактивов и условий проведения реакций, необходимых для осуществления превращений:
Al — AlBr3 — Al(OH)3 — Al2O3 — AlCl3 — Al(OH)3
А. HCl
HCl
Б. KOH
В. HBr
Г. NaOH
Д. t°С
варіанти відповідей
Запитання 9
Из какого сырья изготавливают абразивный материал?
варіанти відповідей
каолина
криолита
корунда
полевого шпата
Запитання 10
Алюминий будет реагировать с
варіанти відповідей
концентрированной нитратной кислотой
концентрированной сульфатной кислотой при температуре 0°С
водой при условии отсутствия оксидной плёнки на его поверхности
калий оксидом с образованием калия
Запитання 11
Формулы веществ, во время взаимодействия которых можно получить алюминий гидроксид?
варіанти відповідей
Al(NO3)3 и Ba(OH)2
AlPO4 и LiOH
Al2O3 и h3O
KAlO2 и NaOH
Запитання 12
Какие вещества взаимодействуют с Al2O3?
варіанти відповідей
KOH, h3O
Ca(OH)2, HCl
h3SO4, h3O
NaOH, Zn(OH)2
Запитання 13
Какая формула криолита?
варіанти відповідей
Al2O3*3h3O
Na3[AlF6]
Запитання 14
Вещество, которое использует для Al2O3 —
варіанти відповідей
Na3[AlF6]
Al(OH)3
Запитання 15
Вещества, которые будут вступать в реакцию с Al(OH)3 —
варіанти відповідей
Запитання 16
Реактивы, которые будут вступать в реакцию с Al2(SO4)3 —
варіанти відповідей
Запитання 17
Продукты разложения Al(NO3)3 —
варіанти відповідей
Al + NO2 + O2
Al2O3 + NO2 + O2
Al(NO2)3 + O2
Запитання 18
Неметаллы, взаимодействуют с алюминием при стандартных условиях —
варіанти відповідей
N2, Cl2
Cl2, Br2
S, Br2
Запитання 19
Формулы продуктов взаимодействия алюминий карбида с водой —
варіанти відповідей
Al(OH)3 и Ch5
Alh4 и Ch5
Al2O3 и Сh5
Al(OH)3 и C2h3
Запитання 20
Формулы веществ, с которыми взаимодействует алюминий —
варіанти відповідей
HCl, h3
C, HNO3 (конц. )
)
S, HCl
h3SO4 (конц.), HCl
Запитання 21
Действие какого реагента на алюминий приведёт к появлению h3?
варіанти відповідей
ортофосфорной кислоты
концентрированной h3SO4
разбавленной HNO3
раствора калий гидроксида
Запитання 22
В промышленности алюминий получают
варіанти відповідей
электролизом расплава AlCl3
электролизом расплава алюминий оксида в криолите
электролизом расплава Al2O3
электролизом раствора Al(NO3)3
Запитання 23
Какие вещества необходимо использовать для получения Al(OH)3?
варіанти відповідей
Al2O3 и h3O
Al(NO3)3 + CsOH
Na[Al(OH)4] и NaOH
Na3[AlF6] и K2O
Запитання 24
Определите формулу вещества А в реакции Al + h3O = A + h3, которая образуется после уничтожения оксидной плёнки на поверхности алюминия?
варіанти відповідей
K[Al(OH)4]
Al(OH)3
Запитання 25
Алюминий гидроксид принадлежит к
варіанти відповідей
амфотерным оксидам
основным оксидам
кислотным оксидам
несолетворным оксидам
Запитання 26
Предложите вещество, которое нужно использовать с целью осуществления превращения Al2O3 — Al3+
варіанти відповідей
Запитання 27
Выберите формулы веществ, которые в водном растворе диссоциируют с образованием Al(3+)
варіанти відповідей
Al2(SO4)3
Al(OH)3
Al(NO3)3
Запитання 28
Термит — это смесь
варіанти відповідей
эквивалентных количеств алюминия и Fe2O3
эквивалентного количеств алюминия и железной окалины
эквивалентных количеств Al и Fe2O3
эквивалентных количеств Al и Al2O3
Запитання 29
Калий тетрагидроксоалюминат принадлежит к
варіанти відповідей
двойным солям
основным солям
кислым солям
комплексным солям
Запитання 30
Количество электронов, которое содержит атом алюминия на внешнем электронном слое
варіанти відповідей
Запитання 31
Чем алюминий заслужил свой интерес среди химиков?
варіанти відповідей
он не проводит электричество
он блестит
он пластичен
Запитання 32
С какими из перечисленных веществ реагирует алюминий?
варіанти відповідей
h3SO4 (разб. )
)
галогены
раствор CuSO4
Запитання 33
Установите соответствие между формулой вещества и его названием:
Название
1. Бокситы
2. Каолинит
3. Полевой шпат
4. Берилл
Формула
А. 3BeO*Al2O3*6SiO2
Б. K2O*Al2O3*6SiO2
В. Al2O3*3h3O
Г. Al2O3*2SiO2*2h3O
варіанти відповідей
1-В, 2-А, 3-Б, 4-Г
1-Б, 2-Г, 3-А, 4-В
1-В, 2-Г, 3-Б, 4-А
1-А, 2-Б, 3-В, 4-Г
Запитання 34
Подберите правильное ионно-молекулярное уравнение к реакции:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
варіанти відповідей
AlCl3 + 3OH- = Al(OH)3 + 3Cl-
Na(+) + Cl- = NaCl
Al(3+) + 3OH- = Al(OH)3
AlCl3 + 3Na+ = Al(3+) + 3NaCl
Запитання 35
Подберите реагенты к ионному уравнению:
Al(OH)3 + 3H+ = Al(3+) + 3h3O
варіанти відповідей
Al(OH)3 + HBr =
Al(OH)3 + h3SiO3 =
Al(OH)3 + h4PO4 =
Al(OH)3 + HNO3 =
Запитання 36
Подберите реагенты к ионному уравнению:
Al(3+) + PO4(3-) = AlPO4
варіанти відповідей
Al2(SO4)3 + Na3PO4 =
Al(NO3)3 + Ca3(PO4)2 =
Al + Ca3(PO4)2 =
Al + h4PO4 =
Запитання 37
Подберите ионно-молекулярное уравнение к молекулярному:
2Al + 6HCl = 2AlCl3 + 3h3
варіанти відповідей
Al + 3Cl- = AlCl3
Al + 6HCl = 2Al(3+) + 6Cl- + 3h3
Al + 6H(+) + 6Cl- = 2Al(3+) + 6Cl- + 3h3
Al + 6H+ = Al(3+) + 3h3
Запитання 38
Подберите ионно-молекулярное уравнение к молекулярному:
3CuSO4 + 2Al = 3Cu + Al2(SO4)3
варіанти відповідей
3Cu(2+) + 3SO4(2-) + 2Al = 3Cu + 2Al(3+) + 3SO4(2-)
3Cu(2+) + 2Al = 3Cu + 2Al(3+)
Запитання 39
К сильным электролитам относят:
варіанти відповідей
Al(OH)3
Al2(SO4)3
Al(NO3)3
Запитання 40
Тип связи в соединении Al2(SO4)3 —
варіанти відповідей
ковалентная неполярная
ковалентная полярная
ионная
металлическая
Запитання 41
Закончите схему реакции:
Al(OH)3 + HCl =
Определите сумму коэффициентов в данном уравнении:
варіанти відповідей
Запитання 42
Расставьте коэффициенты в уравнении: Al(NO3)3 = Al2O3 + NO2 + O2
Укажите сумму полученных коэффициентов:
варіанти відповідей
Запитання 43
Закончите схему реакции Al + h3SO4 =
Определите сумму полученных коэффициентов:
варіанти відповідей
Запитання 44
Закончите схему реакции: Al + NaOH + h3O =
Определите сумму коэффициентов в полученном уравнении:
варіанти відповідей
Запитання 45
Закончите схему реакции: Al + CuSO4 =
Определите сумму коэффициентов в полученном уравнении:
варіанти відповідей
Запитання 46
Закончите схему реакции: Al + HNO3 (разб.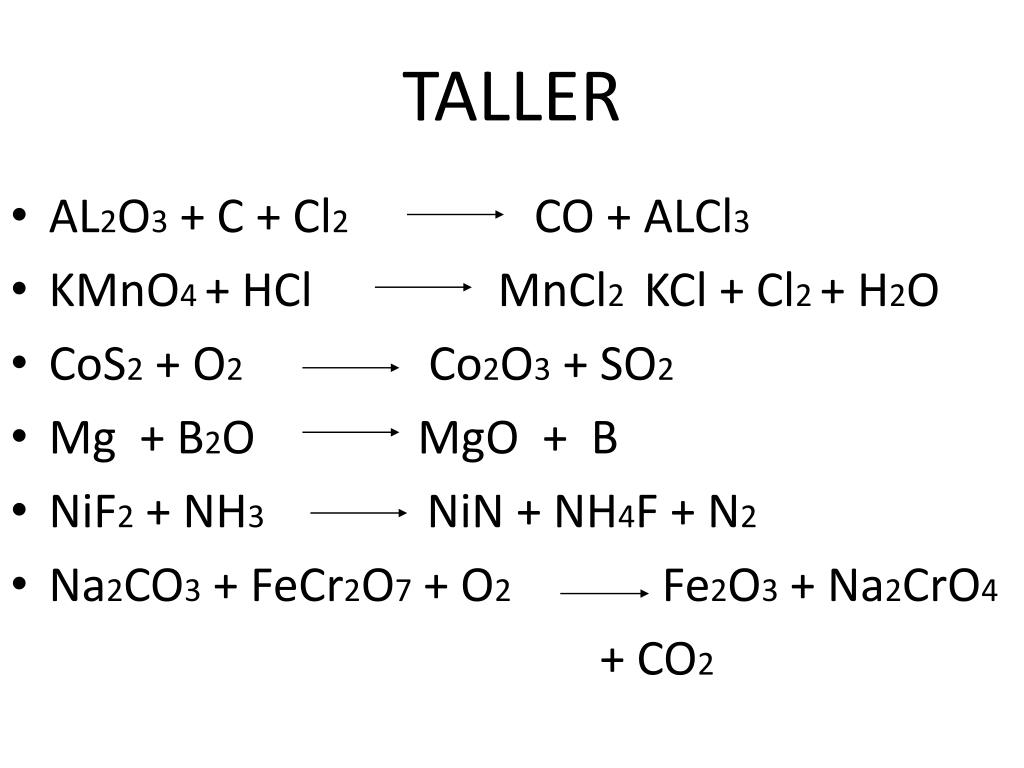 ) =
) =
Определите сумму полученных коэффициентов в уравнении:
варіанти відповідей
Запитання 47
Завершите схему реакции: Al2(SO4)3 + KOH =
Определите сумму коэффициентов в полученном уравнении:
варіанти відповідей
Запитання 48
Завершите схему уравнения: Al(NO3)3 + Na3PO4 =
Определите сумму полученных коэффициентов:
варіанти відповідей
Запитання 49
Соответственно с уравнением химической реакции:
Al + KOH + h3O + KNO3 =
составьте схему электронного баланса и укажите сумму коэффициентов:
варіанти відповідей
Запитання 50
Соответственно с уравнением химической реакции реакции:
Al + KMnO4 + h3SO4 = Al2(SO4)3 + MnSO4 + K2SO4 + h3O
составьте схему электронного баланса и укажите сумму коэффициентов:
варіанти відповідей
Запитання 51
Определите объём водорода, полученного при взаимодействии 36 г алюминия с сульфатной кислотой h3SO4 m = 142 г (ρ = 1,105 г/мл, ω = 15%)
варіанти відповідей
5,38 л
5,67 л
5,82 л
5,12 л
Запитання 52
Определите массу Al2O3, полученного при разложении 117 г Al(OH)3:
варіанти відповідей
76,5 г
75,2 г
74,2 г
Запитання 53
Определите массу Al(OH)3 пр взаимодействии растворов 75 г Al2(SO4)3 с массовой долей соли 25 % и 100 г NaOH с массовой долей соли 30 %:
варіанти відповідей
8,24 г
8,55 г
8,78 г
Запитання 54
Массовая доля Al = 34,62 %, тогда формула соединения алюминия —
варіанти відповідей
Al2(SO4)3
Al(NO3)3
Al(OH)3
Запитання 55
Сколько потребуется алюминия, чтобы при реакции с соляной кислотой получить столько водорода, сколько его выделяется при взаимодействии 1 моль натрия с водой?
варіанти відповідей
Запитання 56
При взаимодействии алюминия количеством вещества 0,75 моль с неизвестным галогеном получили 200,25 г алюминий галогенида. Какой галоген использовали?
Какой галоген использовали?
варіанти відповідей
Запитання 57
При алюмотермическом восстановлении 128 г Fe2O3 получили 68 г железа. Какая массовая доля выхода металла (%)?
варіанти відповідей
75,9 %
72,5 %
76,7 %
Запитання 58
Какую массу раствора натрий гидроксида с массовой долей щёлочи 30 % нужно использовать для осаждения Al(OH)3 с раствора AlCl3 массой 400 г с массовой долей соли 20 %?
варіанти відповідей
Запитання 59
Определите массовую долю HCl (%) в хлоридной кислоте массой 400 г, если в ней можно растворить 0,2 моль алюминия?
варіанти відповідей
Запитання 60
Определите объём водорода полученный при растворении смеси алюминия и меди массой 13,5 г в водном растворе щёлочи? Массовая доля меди в смеси составляет 20%.
варіанти відповідей
13,8 л
13,4 л
14,67 л
15,22 л
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Створити тест
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Al2O3 + 6HCl = 2AlCl3 + 3h3O
| Поиск |
оксид алюминия + хлороводород = хлорид алюминия + вода |
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Реакция двойной замены
| png» substance-weight=»101.96128 ± 0.00090″> Al 2 O 3 | + | 6HCl | → | 2AlCl 3 | + | 3H 2 O | |||
| aluminium oxide | Хлорид водорода | Хлорид алюминия | Вода | ||||||
| (RắN) | 9000 | (dd) | (kt) | (lỏng) | |||||
| (trắng) | (không màu) | (trắng) | (không màu) | ||||||
| 1 | 6 | 2 | 3 | Hệ Số | |||||
| 9000 9000 | 9000 9000 | . | |||||||
| Số mol | |||||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении Al
2 O 3 + 6HCl → 2AlCl 3 + 3H 2 OВ каких условиях Al2O3 (оксид алюминия) реагирует с HCl (хлороводородом)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта. Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием AlCl3 (хлорид алюминия) и h3O (вода)?
В полном предложении вы также можете сказать, что Al2O3 (оксид алюминия) реагирует с HCl (хлороводородом) и производит AlCl3 (хлорид алюминия) и h3O (вода)
Явление после реакции Al2O3 (оксид алюминия) с HCl (хлороводород)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Другие вопросы, связанные с химическими реакциями Al
2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O2 Вопросы, связанные с реагентом оксид алюминия 3 O0019
Каковы химические и физические характеристики Al2O3 (оксид алюминия)? В каких химических реакциях используется Al2O3 (оксид алюминия) в качестве реагента?
Вопросы, связанные с реагентом HCl (хлороводород)
Каковы химические и физические характеристики HCl (хлороводород)? В каких химических реакциях используется HCl (хлороводород) в качестве реагента?
Вопросы, связанные с продуктом AlCl3 (хлорид алюминия)
Каковы химические и физические характеристики AlCl3 (хлороводород)? Каковы химические реакции, в которых AlCl3 (хлорид алюминия) является продуктом?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (хлористого водорода)? В каких химических реакциях образуется h3O (вода)?
Уравнения с Al2O3 в качестве реагента
оксид алюминия
2AL 2 O 3 → 4AL + 3O 2 AL 2 O 3 + 2NAOH → H 2 O + 2NAALO 2 AL 2 O + 2NAALO 2 AL 2 4 3 . 3 + 3Н 2 О
Просмотреть все уравнения с Al2O3 в качестве реагента
3 + 3Н 2 О
Просмотреть все уравнения с Al2O3 в качестве реагента
Уравнения с HCl в качестве реагента
хлористый водород
2HCl + Zn → H 2 + ZnCl 2 HCl + NaOH → H 2 O + NaCl Fe + 2HCl → FeCl 2 + H 2 Просмотреть все уравнения с HCl в качестве реагента
Рекламное объявление
Уравнения с HCl в качестве продукта
хлористый водород
Класс 2 + C 3 H 8 → HCL + C 3 H 7 CL CO + H 2 O + PDCL 2 → 2HCL + CO 2 + PD CH 4 40034 4 + 40034 4 4 4 4 4 4 4 → 2HCL + CO 2 + PD CH 4 4 → 2HCL + CO 2 + PD CH 4 . Cl 2 → CH 3 Cl + HCl Просмотреть все уравнения с HCl в качестве продукта
Уравнения с HCl в качестве продукта
хлористый водород
Cl 2 + C 3 H 8 → HCl + C 3 H 7 Cl CO + H 2 O + PdCl 2 → 2HCl + CO 2 + Pd CH 4 + Cl 2 → CH 3 Cl + HCl Просмотреть все уравнения с HCl в качестве продукта
Заполните следующие химические уравнения.
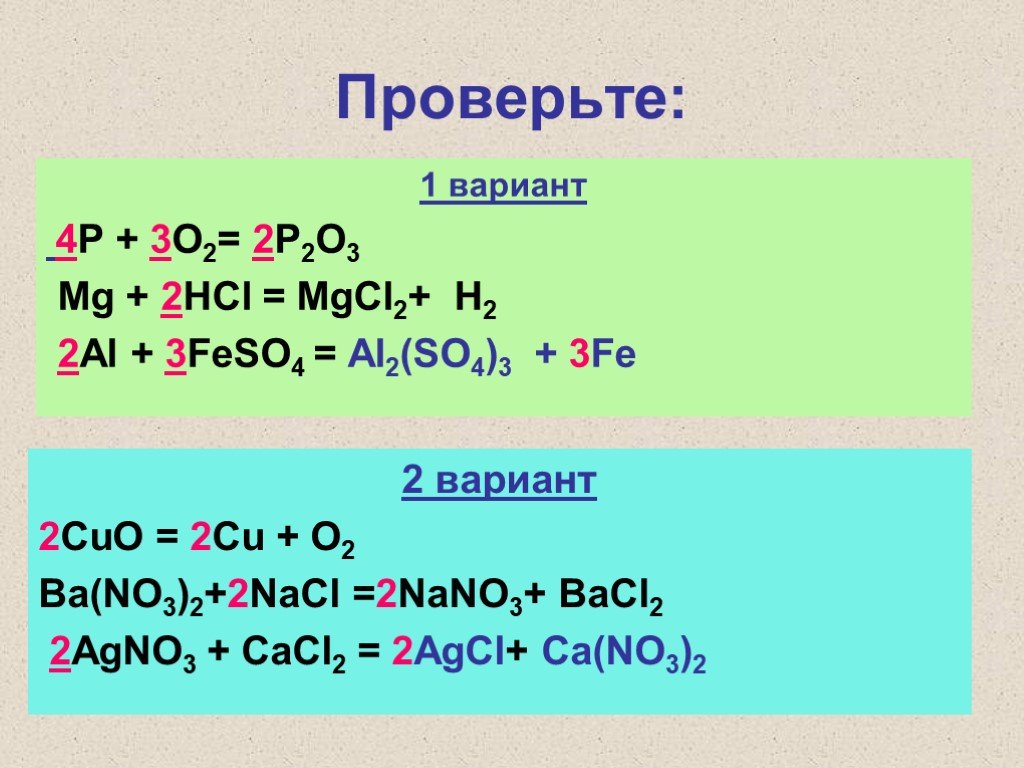 $ A{l_2}{O_3} + 6HCl \\to $ $ A{l_2}{O_3} + 2NaOH \\to $
$ A{l_2}{O_3} + 6HCl \\to $ $ A{l_2}{O_3} + 2NaOH \\to $Ответ
Подтверждено
151,5 тыс.+ просмотров
Подсказка: Амфотерные оксиды может действовать как кислота и основание. Эти оксиды могут реагировать как с кислотами, так и с основаниями с образованием соли и воды. К металлам, образующим амфотерные оксиды, относятся алюминий, цинк, свинец и т. д.
Полный пошаговый ответ:
Алюминий образует амфотерный оксид ( $ A{l_2}{O_3} $ ), что означает, что оксид алюминия может действовать как кислота и как основание. Таким образом, он может реагировать как с кислотой, так и с основанием.
Оксид алюминия ($A{l_2}{O_3}$) реагирует с горячей разбавленной соляной кислотой с образованием хлорида алюминия и воды. Это показывает основную природу оксида алюминия.
$ A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O $
Оксид алюминия ( $A{l_2}{O_3} $ ) реагирует с горячим концентрированным гидроксидом натрия с образованием алюмината натрия и вода.
$ A{l_2}{O_3} + 2NaOH \to 2NaAl{O_2} + {H_2}O $
Таким образом, эти реакции предсказывают амфотерную природу оксида алюминия. Природа реагента определяет кислотную или основную природу оксида алюминия в химической реакции. Оксид алюминия используется в качестве катализатора во многих химических реакциях. Он также используется в косметических продуктах, таких как румяна, губная помада и т. Д. Также входит в состав солнцезащитного крема. Оксид алюминия также действует как керамический оксид и имеет множество применений.
Дополнительная информация:
Мы видели, что оксид алюминия является амфотерным оксидом. Оксид цинка также действует как амфотерный оксид, проявляя реакцию как с кислотой, так и с основанием. Оксид цинка ($ZnO$) реагирует с соляной кислотой с образованием хлорида цинка ($ZnC{l_2}$) и воды. Он реагирует с гидроксидом натрия с образованием цинката натрия ($ N{a_2}Zn{O_2}$) и воды.
Примечание:
Мы завершили данные химические уравнения, учитывая амфотерную природу оксида алюминия, а затем сбалансировали уравнение.

 0006
0006