Сa+h3O=Ca(OH)2 составить уравнение попонятней… -reshimne.ru
Новые вопросы
Ответы
Ca+2h3O=Ca(OH)2+h3
Щелочные и щелочно-земельные металлы реагируют с h3O, с образованием щёлочи(у щелочных), основания(у щелочно-земельных) и выделяется при этом h3.
Похожие вопросы
Составь формулу соединения железа (|||) с серой (||)…
СРОООЧНОО!
Какова валентность элементов в соединениях ZnS,Cu (индекс 2) S,Al (индекс 2) S (индекс 3),Sn S(индекс 2),P(индекс 2)Sn….
Назовите элемент формула валентных электронов которого 3s23p5…
Сложить уравнение реакции: Перманганат Калия ->
Указать ее тип. ..
..
2-бромбутан с гидроксидом натрия?…
Мне нужна помощь с решением нужно сделать уравнения с серной кислотой по другому S2SO4, полное и сокращённое уравнение,а также ионное и молекулярное. Срочно!…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
ХимияФизика
Биология
Другие предметы
История
Обществознание
Окружающий мир
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню.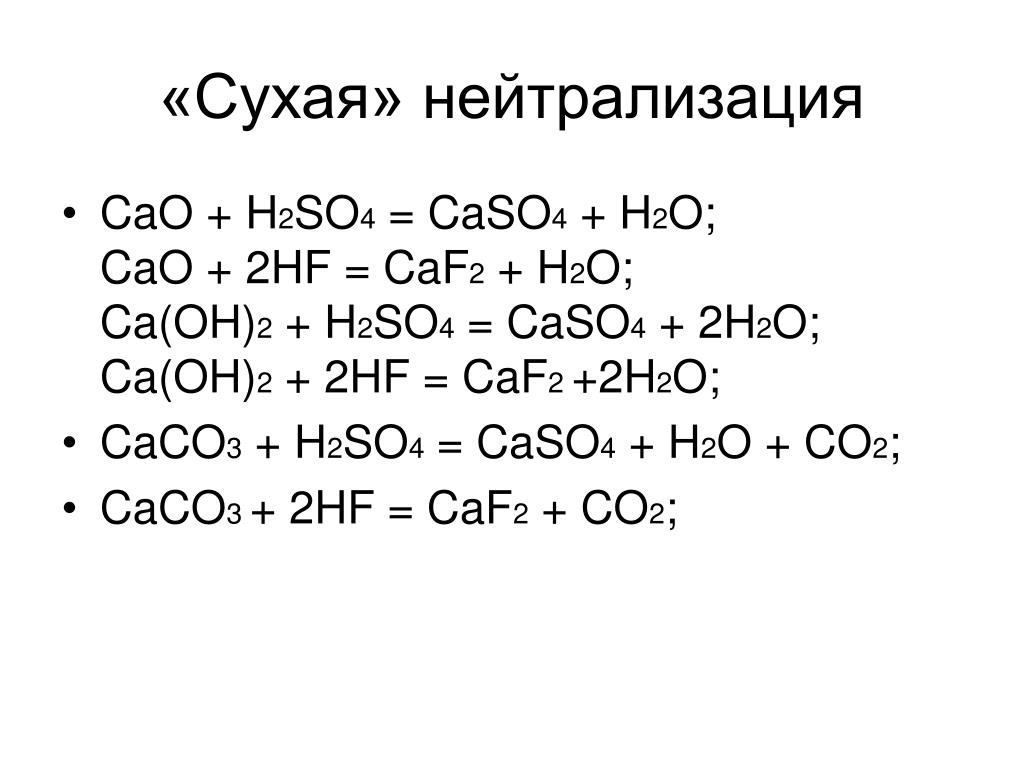 Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.

Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом.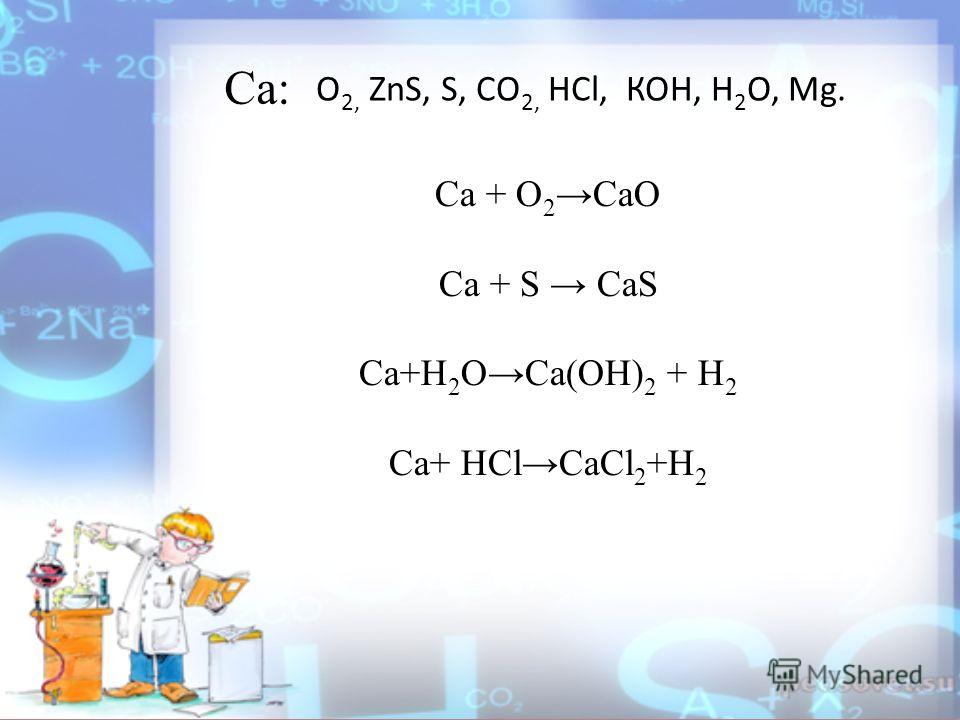 Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Ca + 2h3O = Ca(OH)2 + h3
| Поиск |
кальций + вода = гидроксид кальция + водород | Температура: комнатная
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявлениеСодержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция
| 01528 ± 0.00044″> 2H 2 O | → | H 2 | |||||||||||||||
| calcium | Water | Гидроксид кальция | Водород | ||||||||||||||
| (RắN) | (LỏNG) | (LỏNG) | (RắN) | (LỏNG) | (RắN) | (LỏNG) | (RắN)0005 | (dd) | (khí) | ||||||||
| (trắng) | (không màu) | (không màu) | |||||||||||||||
| 1 | 2 | 1 | 1 | Hệ Số | |||||||||||||
| NGUYEN — PHân Tử KHốI (G/MOL) | |||||||||||||||||
| Số mol | |||||||||||||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении Ca + 2H
2 O → Ca(OH) 2 + H 2В каких условиях Ca (кальций) реагирует с h3O (водой)?
Температура: комнатная температура
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Ca(OH)2 (гидроксид кальция) и h3 (водород) ?
В полном предложении вы также можете сказать, что Ca (кальций) реагирует с h3O (водой) и производит Ca(OH)2 (гидроксид кальция) и h3 (водород)
Явление после реакции Ca (кальция) с h3O (водой)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями Ca + 2H
2 O → Ca(OH) 2 + H 2Вопросы, связанные с реагентом Ca (кальцием)
Каковы химические и физические характеристики Ca (кальция)? В каких химических реакциях используется Ca (кальций) в качестве реагента?
Вопросы, связанные с реагентом h3O (вода)
Каковы химические и физические характеристики h3O (воды)? В каких химических реакциях используется h3O (вода) в качестве реагента?
Вопросы, связанные с продуктом Ca(OH)2 (гидроксид кальция)
Каковы химические и физические характеристики Ca(OH)2 (вода)? Какие химические реакции происходят с Ca(OH)2 (гидроксид кальция) как продукт?
Вопросы, связанные с продуктом h3 (водород)
Каковы химические и физические характеристики h3 (воды)? Каковы химические реакции, в которых продуктом является h3 (водород)?
Уравнения с кальцием в качестве реагента
кальций
3Ca + N 2 → Ca 3 N 2 2C + Ca → CaC 2 Ca + 1/2O 2 → CaO Просмотреть все уравнения с кальцием в качестве реагента
Уравнения с h3O в качестве реагента
вода
BR 2 + H 2 O + (NH 4 ) 2 SO 3 → (NH 4 ) 2 SO 4 + 2HBR FER 2 2 2 2 2 2 2 2 2 2 2 2 (SO 4 + 2HBR FE 2 2 2 2 2 (SO 4 + 2HBR. ) 3 + 3H 2 O → 3CO 2 + 2Fe(OH) 3 2H 2 O + 2NaCl → Cl 2 902Na + 3 OH Просмотреть все уравнения с h3O в качестве реагента
) 3 + 3H 2 O → 3CO 2 + 2Fe(OH) 3 2H 2 O + 2NaCl → Cl 2 902Na + 3 OH Просмотреть все уравнения с h3O в качестве реагента
Рекламное объявление
Уравнения с h3O в качестве произведения
вода
10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 3BAO + 2H 3 PO 4 → 3H 2 O + BA 3 (PO 4 ) 2 2 (NH 4 ) 3 PO 8 4 + 3BA () 3 PO 88 4 + 3BA () 3 PO 8 4 + 3BA (). 2 → 6H 2 O + 6NH 3 + Ba 3 (ПО 4 ) 2 Просмотреть все уравнения с h3O в качестве произведения
Уравнения с h3O в качестве произведения
вода
3NH 4 NO 3 + CH 2 → 7H 2 O + 3N 2 + CO 2 NAOH + C 6 H 5 BR → C 6 5 5 5 5 5 5 5 5 H 6 5 H 6 H 6 H 6 6 6 6 . ONa + H 2 O + NaBr 10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 Просмотреть все уравнения с h3O в качестве произведения
ONa + H 2 O + NaBr 10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MnSO 4 + K 2 SO 4 Просмотреть все уравнения с h3O в качестве произведения
Сбалансируйте уравнение — HNO3+Ca(OH)2 → Ca(NO3)2 + h3O
Последнее обновление: 2 июля 2021 г., Teachoo
Сбалансируйте следующие химические уравнения.
а) ННО
3 +Са(ОН) 2 → Са (НЕТ 3 ) 2 + Н 2 ООтвечать
- HNO 3 + Са(ОН) 2 → Са (НЕТ 3 ) 2 + Н 2 О
Имя элемента | Количество атомов в реагентах | Количество атомов в продуктах |
Водород | 3 | 2 |
Азот | 1 | 2 |
Кислород | 5 | 7 |
Кальций | 1 | 1 |
Чтобы сбалансировать азот,
Умножить HNO 3 на 2
2 HNO 3 + Са(ОН) 2 → Са (НЕТ 3 ) 2 + Н 2 О
Имя элемента | Количество атомов в реагентах | Количество атомов в продуктах |
Водород | 4 | 2 |
Азот | 2 | 2 |
Кислород | 8 | 7 |
Кальций | 1 | 1 |
Чтобы сбалансировать водород,
Умножить H 2 О на 2
2 HNO 3 + Са(ОН) 2 → Са (НЕТ 3 ) 2 + 2 ЧАС 2 О
Имя элемента | Количество атомов в реагентах | Количество атомов в продуктах |
Водород | 4 | 4 |
Азот | 2 | 2 |
Кислород | 8 | 8 |
Кальций | 1 | 1 |
Теперь все элементы уравновешены, и сбалансированное уравнение
2 HNO 3 + Са(ОН) 2 → Са (НЕТ 3 ) 2 + 2 ЧАС 2 О
2 HNO 3 + Са(ОН) 2 → Са (НЕТ 3 ) 2 + 2 ЧАС 2 О
Разрешите все свои сомнения с Teachoo Black (новый месячный пакет уже доступен!)
Присоединяйтесь к Teachoo Black
Кальций (Ca) и вода
Кальций встречается в воде естественным образом. Морская вода содержит приблизительно 400 частей на миллион кальция. Одной из основных причин обилия кальция в воде является его естественное залегание в земной коре. Кальций также входит в состав кораллов. Реки обычно содержат 1-2 части на миллион кальция, но в известняковых районах концентрация кальция в реках может достигать 100 частей на миллион.
Морская вода содержит приблизительно 400 частей на миллион кальция. Одной из основных причин обилия кальция в воде является его естественное залегание в земной коре. Кальций также входит в состав кораллов. Реки обычно содержат 1-2 части на миллион кальция, но в известняковых районах концентрация кальция в реках может достигать 100 частей на миллион.
Примеры концентраций кальция в водных организмах: морские водоросли luctuca 800-6500 ppm (влажная масса), устрицы примерно 1500 ppm (сухая масса).
В водном растворе кальций в основном присутствует в виде Ca 2+ (водн.), но может также встречаться в виде CaOH + (водн.) или Ca(OH) 2 (водн.) или в виде CaSO 4 в морской воде.
Кальций является важным фактором, определяющим использование воды, а также действует как стабилизатор pH благодаря своим буферным свойствам. Кальций также придает воде лучший вкус.
Каким образом и в какой форме кальций реагирует с водой?
В отличие от магния, расположенного непосредственно над кальцием в периодической таблице, элементарный кальций реагирует с водой при комнатной температуре по следующему механизму реакции:
Ca (т) + 2H 2 O (г) -> Ca( OH) 2 (водн. ) + H 2 (g)
) + H 2 (g)
В результате этой реакции образуется гидроксид кальция, растворяющийся в воде в виде соды, и газообразный водород.
Другими важными механизмами реакции кальция являются реакции эрозии. Обычно это происходит при наличии углекислого газа. В нормальных условиях карбонат кальция нерастворим в воде. В присутствии углекислого газа образуется угольная кислота, влияющая на соединения кальция.
Механизм реакции выветривания углерода следующий: HCO 3 ) 2
А общий механизм реакции:
CaCO 3 (с) + CO 2 (г) + 2H 2 O (ж)-> Ca20 90+ водный) + 2 HCO 3 — (водный)
Продукт представляет собой гидрокарбонат кальция.
Растворимость кальция и соединений кальция
Элементарный кальций реагирует с водой. Соединения кальция более или менее растворимы в воде. Карбонат кальция имеет растворимость 14 мг/л, что умножается на пять в присутствии двуокиси углерода. Растворимость фосфата кальция 20 мг/л, фторида кальция 16 мг/л. Растворимость хромата кальция 170 г/л, а при 0 o С растворимость гипохлората кальция 218 г/л. Растворимость других соединений кальция находится между уровнями этих примеров, например арсената кальция 140 мг/л, гидроксида кальция 1,3 г/л и сульфата кальция 2,7-8,8 г/л.
Растворимость фосфата кальция 20 мг/л, фторида кальция 16 мг/л. Растворимость хромата кальция 170 г/л, а при 0 o С растворимость гипохлората кальция 218 г/л. Растворимость других соединений кальция находится между уровнями этих примеров, например арсената кальция 140 мг/л, гидроксида кальция 1,3 г/л и сульфата кальция 2,7-8,8 г/л.
Почему кальций присутствует в воде?
Кальций естественно присутствует в воде. Он может растворяться в горных породах, таких как известняк, мрамор, кальцит, доломит, гипс, флюорит и апатит. Кальций является определяющим фактором жесткости воды, поскольку он присутствует в воде в виде ионов Ca 2+ . Магний является другим определяющим фактором твердости.
Кальций присутствует в различных строительных материалах, таких как цемент, кирпичная известь и бетон. Он присутствует в батареях и применяется в гипсе в виде сульфата кальция. Металл применяется для производства циркония и тория. В сталелитейной промышленности кальций применяется в качестве промокателя и добавляется в алюминиевые, медные и свинцовые сплавы. Кальций может извлекать диоксид серы из промышленных выхлопов и нейтрализовать серные кислоты перед сбросом. Другими примерами применения кальция являются гипохлорид кальция в качестве отбеливателя и для дезинфекции, фосфат кальция в стекольной и фарфоровой промышленности, полисульфид и гидроксид кальция в качестве флокулянтов при очистке сточных вод и фторид кальция в качестве агента помутнения в производстве эмалей, в УФ-спектроскопии и в качестве сырье для производства жидкой кислоты. Кальций также может применяться для удаления углерода и серы из железа и его сплавов, а также для обезвоживания нефти. Известняк применяется в качестве наполнителя для бумаги, благодаря чему бумага становится белее, а в пластмассах — для повышения стабильности.
Кальций может извлекать диоксид серы из промышленных выхлопов и нейтрализовать серные кислоты перед сбросом. Другими примерами применения кальция являются гипохлорид кальция в качестве отбеливателя и для дезинфекции, фосфат кальция в стекольной и фарфоровой промышленности, полисульфид и гидроксид кальция в качестве флокулянтов при очистке сточных вод и фторид кальция в качестве агента помутнения в производстве эмалей, в УФ-спектроскопии и в качестве сырье для производства жидкой кислоты. Кальций также может применяться для удаления углерода и серы из железа и его сплавов, а также для обезвоживания нефти. Известняк применяется в качестве наполнителя для бумаги, благодаря чему бумага становится белее, а в пластмассах — для повышения стабильности.
Кальций часто положительно влияет на качество почвы, и различные соединения вносятся в качестве удобрения. Например, растворы CaCl 2 — или Ca(NO) 3 применяются в садоводстве. Оксид кальция является обезвоживающим моллюскоцидом.
Каково воздействие кальция в воде на окружающую среду?
Кальций необходим всем организмам, за исключением некоторых насекомых и бактерий. Карбонат кальция является строительным камнем скелетов большинства морских организмов и глазных линз. Фосфат кальция необходим для структуры костей и зубов наземных организмов. Растения в основном содержат оксалат кальция. Запас кальция в растениях составляет около 1% от сухой массы.
Кальций в значительной степени отвечает за жесткость воды и может негативно влиять на токсичность других соединений. Такие элементы, как медь, свинец и цинк, гораздо более токсичны в мягкой воде.
В известкованных почвах кальций может иммобилизовать железо. Это может вызвать нехватку железа, даже если в почве его много.
Жесткость воды влияет на токсичность металлов для водных организмов. В более мягкой воде проницаемость мембран жабр увеличивается. Кальций также конкурирует с другими ионами за места связывания в жабрах. Следовательно, жесткая вода лучше защищает рыб от прямого поглощения металлов. Значения pH 4,5-4,9может нанести вред икре лосося и взрослым лососям при низком содержании кальция, натрия и хлора.
Следовательно, жесткая вода лучше защищает рыб от прямого поглощения металлов. Значения pH 4,5-4,9может нанести вред икре лосося и взрослым лососям при низком содержании кальция, натрия и хлора.
Различные соединения кальция могут быть токсичными. ЛД 50 крыс для арсенита кальция составляет 20 мг/кг массы тела. Карбид кальция образует легковоспламеняющийся этин при контакте с водой и поэтому считается опасным.
Некоторые воздействия жесткости воды на окружающую среду включают повышение жесткости бытового оборудования, поскольку высокие температуры вызывают карбонатную жесткость. Это может резко сократить срок службы оборудования и привести к увеличению бытовых отходов. Карбонат кальция взаимодействует с моющими и чистящими средствами. Комплексообразование вызывает снижение эффективности моющих средств, что приводит к потребности в более частом применении моющих средств и покупке смягчителей (см. также магний и вода).
Умягчение часто проводят с помощью ионообменников. Это должны быть регенераты с поваренной солью и, следовательно, отягощающие сточные воды.
Это должны быть регенераты с поваренной солью и, следовательно, отягощающие сточные воды.
Существует шесть стабильных изотопов кальция. На сегодняшний день известно о восьми нестабильных изотопах кальция. 45 Ca высокорадиоактивен и токсичен.
Как влияет на здоровье содержание кальция в воде?
Кальций является диетическим минералом, присутствующим в организме человека в количестве около 1,2 кг. Никакого другого элемента в организме нет в избытке. Фосфат кальция является вспомогательным веществом и вызывает рост костей и зубов вместе с витамином D. Кальций также присутствует в мышечной ткани и в крови. Он необходим для развития клеточных мембран и деления клеток, а также частично отвечает за сокращение мышц и свертывание крови. Кальций регулирует активность мембран, способствует передаче нервных импульсов и высвобождению гормонов, стабилизирует pH тела и является неотъемлемой частью зачатия. Для стимуляции этих функций организма взрослым рекомендуется ежедневный прием около 1000 мг кальция. Этого можно достичь, употребляя молочные продукты, зерновые и зеленые овощи.
Этого можно достичь, употребляя молочные продукты, зерновые и зеленые овощи.
Карбонат кальция действует как средство от желудочной кислоты и может применяться для устранения расстройства пищеварения. Лактат кальция может помочь организму в периоды дефицита кальция, а хлорид кальция является мочегонным средством.
Жесткая вода может способствовать укреплению костей и зубов из-за высокого содержания в ней кальция. Это также может снизить риск сердечных заболеваний. Жесткость питьевой воды должна быть выше 8,4 o dH. Карбонат кальция положительно влияет на свинцовые водопроводные трубы, так как образует защитное покрытие из карбоната свинца(II). Это предотвращает растворение свинца в питьевой воде и тем самым предотвращает его попадание в организм человека.
Прием большого количества кальция может отрицательно сказаться на здоровье человека. Смертельная доза при пероральном приеме составляет около 5-50 мг/кг массы тела. Металлический кальций разъедает кожу при контакте с кожей, глазами и слизистыми оболочками.

