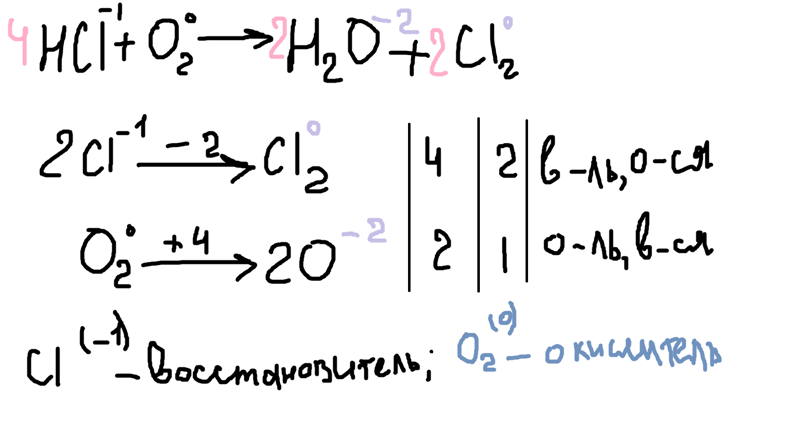Решебник по химии за 9 класс к учебнику Химия. 9 класс Л.С.Гузей и др.Глава 19. Химия элементов-неметаллов. §19.9 Фосфор и его соединения
Решебники и ГДЗ
Начните вводить часть условия (например, могут ли, чему равен или найти):
- 1*. Приведите примеры соединений азота и фосфора одинаковой «формы».
- 2*. Почему атом фосфора больше атома азота? От чего зависит размер атома?
- 3*. Почему при обычных условиях сера, в отличие от газообразного кислорода, является твердым веществом?
- 4. Почему температуры плавления и кипения галогенов повышаются с увеличением их атомного номера?
- 5*. Чем можно объяснить сравнительно большое отличие физических и химических свойств кислорода и серы, являющихся соседями в одной группе периодической системы?
- 6*. Сколько видов АО имеется на 4-м энергетическом уровне? на 5-м? на 100-м?
- 7. Что является более сильным окислителем — N2O5 или Р2O5? Р2O5 или Sb2O5? Ответ поясните.

- 8. Какое соединение более устойчиво (менее реакционноспособно) — Nh4 или РН3? РН3 или Sbh4? Ответ мотивируйте.
- 9*. Какое соединение является более сильным восстановителем — Nh4 или РН3? РН3 или Sbh4? Ответ мотивируйте.
- 10*. Что является более сильным окислителем — Cl2O7 или Br2O7? Ответ поясните.
- 11. Какое соединение более устойчиво (менее реакционноспособно) — Н2O или h3S? Ответ мотивируйте.
- 12*. Какое соединение является более сильным восстановителем — h3S или h3Se? h3Se или Н2Те? Ответ мотивируйте.
- 13*. Чему равна валентность кислорода в O2? азота в N2? (Прежде чем отвечать на вопрос, вспомните определение валентности, данное в §3.1 и разъясненное в §18.2.)
- 14. Что такое аллотропия? (Для забывших — см. §4.5.)
- 15. Какую валентность имеет фосфор в оксиде, получающемся при окислении белого фосфора? при горении красного?
- 16*. Из каких молекул состоят кристаллы белого фосфора? красного фосфора?
- 17.
 Почему диссоциация многоосновных кислот наибольшая на первой и наименьшая на последней ступенях?
Почему диссоциация многоосновных кислот наибольшая на первой и наименьшая на последней ступенях? - 18*. Во сколько раз степень диссоциации фосфорной кислоты по первой ступени больше, чем по второй? по второй, чем по третьей?
- 19. Напишите уравнение реакции фосфата натрия с соляной кислотой и объясните возможность ее осуществления.
- 20. Напишите уравнения реакций, по которым фосфорная кислота получается в промышленных масштабах.
- 21. Назовите, используя химические названия, вещества, применяемые как фосфорные удобрения (см. рис. 19.27).
- 22. Среди удобрений, приведенных на рисунке 19.27, имеются комплексные, т.е. содержащие больше одного питательного элемента. О каких удобрениях идет речь?
- 23*. Какова масса фосфора в вашем теле?
- 24. Используя схему, напишите уравнения реакций 1—9. Объясните окислительно-восстановительный процесс, обозначенный звездочкой.
Поиск по сайту
Тематические задания для подготовки к ЕГЭ по химии | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс):
21. 1 Установите соответствие между уравнением реакции и свойством атома иода в этой реакции:
1 Установите соответствие между уравнением реакции и свойством атома иода в этой реакции:
УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АТОМА ИОДА
А)2HIO3 + 5h3O2 = I2 + 5O2 + 6h3O 1) не проявляет окисл- восстан. свойств
Б) 2SO3 + 2NaI = I2 + SO2 + Na2SO4 2) только окислитель
В) 2FeI2 + 13Cl2 + 12h3O = 2FeCl3 + 4HIO3 + 3) и окислитель, и восстановитель
+ 20HCl 4)только восстановитель
21.2 Установите соответствие между формулой вещества и степенью окисления серы в нём
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ
А) СS2 1) –2
Б) SF6 2) –1
В) Ca(HS)2 3) +1
4) +2
5) +4
6) +6
21. 3 Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества, являющегося в ней восстановителем:
3 Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества, являющегося в ней восстановителем:
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) NO2 + O2 + h3O → HNO3 1) Nh4
Б) HNO3 + Cu → Cu(NO3)2 + NO + h3O 2) h3O
В) Nh4 + O2 → N2 + h3O 3) NO2
4) Cu
5) O2
6) HNO3
30.1 Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуются соль и кислота. Выделение осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс,
Выделение осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс,
укажите окислитель и восстановитель.
30.2 Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид стронция. Допустимо использование водных растворов этих веществ.
Из предложенного перечня веществ выберите вещества, в ходе окислительно- восстановительной реакции между которыми одна молекула восстановителя отдает три электрона. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте
электронный баланс, укажите окислитель и восстановитель в этой реакции
30.3 Для выполнения задания используйте следующий перечень веществ: перманганат калия, хлороводород, хлорид натрия, карбонат натрия, хлорид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.4 Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат марганца(II), вода, карбонат натрия, хлорид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.5 Для выполнения задания используйте следующий перечень веществ: фосфор, хлорноватая кислота, сульфат натрия, хлорид бария, хлорид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция, не сопровождающаяся выделением газа и выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.6 Для выполнения задания используйте следующий перечень веществ: нитрат бария, нитрат калия, хлорид калия, сульфат калия, магний. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выделением газа и выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Составьте электронный баланс, укажите окислитель и восстановитель.
30.7 Для выполнения задания используйте следующий перечень веществ: перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка и выделение газа в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.8 Для выполнения задания используйте следующий перечень веществ: хлороводород, нитрат серебра(I), перманганат калия, вода, азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выделением газа. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
30.9 Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.10 Для выполнения задания используйте следующий перечень веществ: фосфин, сульфат бария, бромноватая кислота, гидрокарбонат кальция, гелий. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
1. Используя метод электронного баланса, составьте уравнение реакции:
Ph4 + HMnO4 ® MnO2 + … + … .
Определите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции:
KNO2 + … + h3SO4 I2 + NO + … + … .
Определите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции:
К2Cr2O7 + HCl → Cl2 + KCl + … + …
Определите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции:
KMnO4 + MnSO4 + h3O → MnO2 + … + … .
Определите окислитель и восстановитель.
5. Используя метод электронного баланса, составьте уравнение реакции
KMnO4+ HCl → MnCl2 + Cl2 + …+ …
Определите окислитель и восстановитель.
6. Используя метод электронного баланса, составьте уравнение реакции:
I2 + K2SO3 + … → K2SO4 + …+ Н2О.
Определите окислитель и восстановитель.
7. Используя метод электронного баланса, составьте уравнение реакции
.
Определите окислитель и восстановитель.
8. Используя метод электронного баланса, составьте уравнение реакции:
FeSO4 + KClO3 + … → Fe2(SO4)3 + … + h3O
Определите окислитель и восстановитель.
9. Используя метод электронного баланса, составьте уравнение реакции
FeSO4 + … + h3SO4 → … + MnSO4 + K2SO4 + h3O
Определите окислитель и восстановитель.
10. Используя метод электронного баланса, составьте уравнение реакции
h3O2 + … + h3SO4 → O2 + MnSO4 + … + …
Определите окислитель и восстановитель.
11. Используя метод электронного баланса, составьте уравнение реакции:
NO2 + P2O3 + . .. → NO + K2HPO4 + … .
.. → NO + K2HPO4 + … .
Определите окислитель и восстановитель.
12. Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 + … + h3SO4 I2 + Cr2(SO4)3 + … + h3O
Определите окислитель и восстановитель.
13. Используя метод электронного баланса, составьте уравнение реакции:
P + HNO3 ® NO2 + … .
Определите окислитель и восстановитель.
14. Используя метод электронного баланса, составьте уравнение реакции:
NaBrO3 + … + NaOH → NaF + NaBrO4 + …
Определите окислитель и восстановитель.
15. Используя метод электронного баланса, составьте уравнение реакции:
Ph4 + HClO3 ® HCl + … .
Определите окислитель и восстановитель.
16. Используя метод электронного баланса, составьте уравнение реакции
KNO2 + KMnO4 + … → KNO3 + MnCl2 + … + h3O
Определите окислитель и восстановитель.
17. Используя метод электронного баланса, составьте уравнение реакции
KI+…+h3SO4→I2+MnSO4+…+h3O
Определите окислитель и восстановитель.
18. Используя метод электронного баланса, составьте уравнение реакции
KNO2 + KMnO4 + … → KNO3 + MnCl2 + … + h3O
Определите окислитель и восстановитель.
19. Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7+h3S+h3SO4→Cr2(SO4)3+K2SO4+…+…
Определите окислитель и восстановитель.
20. Используя метод электронного баланса, составьте уравнение реакции:
NO + КClO + …® КNO3 + КCl + … .
Определите окислитель и восстановитель.
21. Используя метод электронного баланса, составьте уравнение реакции
Na2SO3 + … + KOH → K2MnO4 + … + h3O
Определите окислитель и восстановитель.
22. Используя метод электронного баланса, составьте уравнение реакции
FeSO4 + KClO3 + … → K2FeO4 + … + K2SO4 + h3O
Определите окислитель и восстановитель.
23. Используя метод электронного баланса, составьте уравнение реакции:
Nh4 + KMnO4 + … → … + K2MnO4 + h3O
Определите окислитель и восстановитель.
24. Используя метод электронного баланса, составьте уравнение реакции
CrCl2 + K2Cr2O7 + … → CrCl3 + … h3O
Определите окислитель и восстановитель. (С6Н10О5)n
21.1 Установите соответствие между уравнением реакции и свойством атома иода в этой реакции:
УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АТОМА ИОДА
А)2HIO3 + 5h3O2 = I2 + 5O2 + 6h3O 1) не проявляет окисл- восстан. свойств
Б) 2SO3 + 2NaI = I2 + SO2 + Na2SO4 2) только окислитель
В) 2FeI2 + 13Cl2 + 12h3O = 2FeCl3 + 4HIO3 + 3) и окислитель, и восстановитель
+ 20HCl 4)только восстановитель
21.2 Установите соответствие между формулой вещества и степенью окисления серы в нём
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ
А) СS2 1) –2
Б) SF6 2) –1
В) Ca(HS)2 3) +1
4) +2
5) +4
6) +6
21. 3 Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества, являющегося в ней восстановителем:
3 Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества, являющегося в ней восстановителем:
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) NO2 + O2 + h3O → HNO3 1) Nh4
Б) HNO3 + Cu → Cu(NO3)2 + NO + h3O 2) h3O
В) Nh4 + O2 → N2 + h3O 3) NO2
4) Cu
5) O2
6) HNO3
22.1. Установите соответствие между металлом и способом его электролитического получения
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) расплавленного нитрата
22. 2. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
2. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
А) K2CO3 1) кислород
Б) AgNO3 2) только металл
В) ZnCl2 3) только водород
Г) NaHC2O4 4) металл и водород
5) азот
6) хлор
22.3.Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
А) NaF 1) кислород
Б) Hg(NO3)2 2) металл
В) FeCl2 3) водород
Г) KHSO4 4) сера
5) фтор
6) хлор
30. 1 Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
1 Для выполнения заданий 30, 31 используйте следующий перечень веществ: перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуются соль и кислота. Выделение осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
30.2 Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид стронция. Допустимо использование водных растворов этих веществ.
Из предложенного перечня веществ выберите вещества, в ходе окислительно- восстановительной реакции между которыми одна молекула восстановителя отдает три электрона. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции
В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции
[Решено] Какова степень окисления хлора в Cl2O7 ?
- -2
- +7
- -1
- +1
Вариант 2 : +7
Свободно
Сотовый
6.9 тысяч пользователей
10 вопросов
10 баллов
7 минут
Понятие:
- Степень окисления/степень окисления элемента в соединении – это количество зарядов (положительных или отрицательных), присвоенных атому в молекуле или ионе в соответствии с набором произвольных правил.
Правила присвоения степени окисления:
1. Степень окисления всех элементов в свободном состоянии равна нулю.
2. Самый электроотрицательный элемент, фтор, имеет степень окисления -1 во всех соединениях.
3. Степень окисления одноатомных ионов равна их заряду. Например:
- Степень окисления Li+, Ca2+ и Al3+ равна +1, +2 и +3 соответственно.
- Степень окисления Cl- и SO42- равна -1 и -2 соответственно.
4. Водород имеет степень окисления +1 во всех соединениях, кроме ионных гидридов (степень окисления -1).
5. Степень окисления кислорода -2 в соединении, за исключением перекисей – -1.
6. Щелочные металлы (Li, Na, K и т. д.) всегда имеют +1, а щелочноземельные металлы (Be, Mg и т. д.) имеют +2 степени окисления соответственно.
Расчеты:
Чтобы найти: — степень окисления хлора в Cl2O7.
Пусть степень окисления Хлор (Cl) в Cl2O7 – x.
На основании приведенных выше правил,
2x + 7× (-2) = 0
или 2x -14 = 0
или x = +7.
Следовательно, степень окисления хлора в Cl2O7 равна +7.
Дополнительная информация
Некоторые исключительные примеры степени окисления:
1. Степень окисления двух атомов N в Nh5NO3 различна. Nh5NO3 содержит ионы Nh5+ и NO3-.
Степень окисления двух атомов N в Nh5NO3 различна. Nh5NO3 содержит ионы Nh5+ и NO3-.
В ионе Nh5+ x + 4 ( +1) = +1 Итак, О.Н. N равно -3
В ионе NO3- x + 3 (-2) = -1 Таким образом, O.N N равно +5
2. CaOCl2 состоит из ионов Ca2+, OCl- и Cl-. Следовательно, О.Н. двух атомов хлора в CaOCl2 равны -1 и +1.
Скачать решение PDFПоделиться в WhatsApp
Последние обновления группы D RRB
Последнее обновление: 5 января 2023 г.
RRB Группа D PET Допуск карты выпущен для регионов NFR, NWR, CR, SECR, WCR, NCR, SER, NR, SR 10 января 2023 г. . 4 января 2023 г. выпущена пропускная карта RRB Group D PET для ECoR, WR и SR. Расписание ПЭТ группы D RRB опубликовано для RRB Ajmer. Ссылка на систему показателей группы D RRB активна. Теперь кандидаты могут проверить свои индивидуальные баллы. 26 декабря 2022 года было опубликовано расписание ПЭТ группы D RRB для различных зон. Результаты и отсечки группы D RRB объявлены 22 и 23 декабря 2022 года! Экзамен проводился с 17 августа по 11 октября 2022 года. RRB (Железнодорожная комиссия по найму) проводит экзамен группы D RRB для найма на различные должности ремонтника пути, помощника/ассистента в различных технических отделах, таких как электротехнический, механический, научно-технический и т. д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
Результаты и отсечки группы D RRB объявлены 22 и 23 декабря 2022 года! Экзамен проводился с 17 августа по 11 октября 2022 года. RRB (Железнодорожная комиссия по найму) проводит экзамен группы D RRB для найма на различные должности ремонтника пути, помощника/ассистента в различных технических отделах, таких как электротехнический, механический, научно-технический и т. д. Процесс отбора на эти должности включает в себя 4 этапа: компьютерный тест, тест на физическую работоспособность, проверку документов и медицинский тест.
6.7: Состав в массовых процентах по химической формуле
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 182665
Цели обучения
- Определить процентное содержание каждого элемента в соединении по химической формуле.

Процентный состав соединения также можно определить по формуле соединения. Нижние индексы в формуле сначала используются для расчета массы каждого элемента в одном моле соединения. Это делится на молярную массу соединения и умножается на \(100\%\).
\[\% \: \text{по массе} = \dfrac{\text{масса элемента в} \: 1 \: \text{моль}}{\text{молярная масса соединения}} \times 100 \% \nonumber \]
Процентный состав данного соединения всегда один и тот же, если соединение чистое.
Пример \(\PageIndex{1}\)
Гептоксид дихлора \(\left( \ce{Cl_2O_7} \right)\) представляет собой высокореакционное соединение, используемое в некоторых реакциях органического синтеза. Рассчитайте процентный состав семиокиси дихлора.
Решение
| Действия по решению проблем | Рассчитайте процентный состав семиокиси дихлора \(\left( \ce{Cl_2O_7} \right)\). |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: Cl 2 O 7 Найдите: % состава (% Cl и % O) |
| Перечислите другие известные количества. | Масса Cl в 1 моль Cl 2 O 7 , 2 Cl : 2 x 35,45 г = 70,90 г Масса O в 1 моль Cl 2 O 7 , 7 O: 7 x 16,00 г = 112,00 г Молярная масса Cl 2 O 7 = 182,90 г/моль |
Отмена единиц и расчет. | \[\% \ce{Cl} = \dfrac{70,90 \: \text{g} \: \ce{Cl}}{182,90 \: \text{g}} \times 100\% = 38,76\% \ : \ce{Cl} \номер\] \[\% \: \ce{O} = \dfrac{112,00 \: \text{g} \: \ce{O}}{182,90 \: \text{g}} \times 100\% = 61,24\% \: \ce{O} \nonumber \] Рассчитайте массовые проценты каждого элемента, разделив массу этого элемента в 1 моле соединения на молярную массу соединения и умножив на \(100\%\). |
| Подумайте о своем результате. | Сумма процентов составляет \(100\%\). |
Процентный состав также может быть использован для определения массы определенного элемента, содержащегося в любой массе соединения. В предыдущем примере задачи было обнаружено, что процентный состав семиокиси дихлора равен \(38,76\% \: \ce{Cl}\) и \(61,24\% \: \ce{O}\). Предположим, вам нужно знать массу хлора и кислорода, присутствующих в образце \(12,50 \: \text{г}\) семиокиси дихлора. Вы можете установить коэффициент пересчета на основе процента по массе каждого элемента.
В предыдущем примере задачи было обнаружено, что процентный состав семиокиси дихлора равен \(38,76\% \: \ce{Cl}\) и \(61,24\% \: \ce{O}\). Предположим, вам нужно знать массу хлора и кислорода, присутствующих в образце \(12,50 \: \text{г}\) семиокиси дихлора. Вы можете установить коэффициент пересчета на основе процента по массе каждого элемента.
\[12.50 \: \text{g} \: \ce{Cl_2O_7} \times \dfrac{38.76 \: \text{g} \: \ce{Cl}}{100 \: \text{g} \ : \ce{Cl_2O_7}} = 4,845 \: \text{g} \: \ce{Cl} \nonumber \]
\[12,50 \: \text{g} \: \ce{Cl_2O_7} \times \dfrac {61,24 \: \text{g} \: \ce{O}}{100 \: \text{g} \: \ce{Cl_2O_7}} = 7,655 \: \text{g} \: \ce{O} \nonumber \]
Сумма двух масс равна \(12,50 \: \text{g}\), масса размера выборки.
Упражнение \(\PageIndex{1}\)
Фторид бария — это прозрачный кристалл, который можно найти в природе в виде минерала франкдиксонита. Определите процентный состав фторида бария.
- Ответ а:
- 78,32% Ba и 21,67% F
- Описаны процессы расчета процентного состава соединения на основе химической формулы.



 Почему диссоциация многоосновных кислот наибольшая на первой и наименьшая на последней ступенях?
Почему диссоциация многоосновных кислот наибольшая на первой и наименьшая на последней ступенях?