13 фактов, которые нужно знать
В этой статье мы собираемся изучить структуру, характеристики и 3 важных фактов об уксусной кислоте.
Ch4cooh представляет собой бесцветную жидкость с запахом уксуса. Смешивается с водой. Его сопряженным основанием является ацетат-ион. Ch4cooh в основном используется для производства мономера винилацетата. Молекулярная масса уксусной кислоты составляет 60.052 г/моль.
Чертеж структуры Льюиса Ch4coohВ папке ch4cooh Льюиса, центральный атом C использует гибридную sp2-орбиталь для образования соединения ch4cooh. В возбужденном состоянии C имеет 4 валентных электрона, из которых 1 используется для связи с атомом C –группой Ch4, 1 используется для образования σ-связи с атомом O группы –OH и 1 используется для образования σ-связи с атомом O.
Вторичный 1 валентный электрон используется для образования связи C=O (pi). Карбонильный атом O образует 1σ и 1∏ связь с атомом C, а остальные 4 электрона существуют в виде 2 неподеленных пар. Атом O группы –OH образует 2 σ-связи с группой –Ch4 и атомом H. Остальные 4 электрона, как обычно, существуют в виде 2 неподеленных пар на группе –ОН.
Атом O группы –OH образует 2 σ-связи с группой –Ch4 и атомом H. Остальные 4 электрона, как обычно, существуют в виде 2 неподеленных пар на группе –ОН.
Эмпирический процесс, посредством которого происходит движение электронной пары от одного атома к другому, т. е. распределение электронной пары происходит путем делокализации, называется резонансом, и в результате этого процесса получаемые частицы определяются как резонирующая структура.
В Ch4cooh 2 эквивалентно резонирует структура получается. В этих структурах частичная двойная связь происходит между связью CO. Причина этого в том, что неподеленная электронная пара на атоме О группы –ОН находится в сопряжении с пустой антисвязывающей ∏*-орбиталью карбонильной группы.
Форма структуры Льюиса Ch4coohСогласно теории VSEPR, форма Ch4cooh представляет собой тригональную планировку, в которой центральный карбонильный углерод окружен карбонильным атомом O, группой -Ch4 и группой -OH.
Но C группы –Ch4 тетраэдрически окружен 3 H и группой –C=O, а также атом O группы –OH тетраэдрически окружен группой –C=O, атомом H и 2 неподеленными парами. Ch4cooh существуют в форме планера, так что валентный угол в уксусной кислоте равен 120°.0.
Ch4cooh Структура Льюиса Официальное обвинениеФормальный заряд атомов в Ch4cooh можно получить по формуле, приведенной ниже:
Формальный заряд (FC) = количество валентных электронов-(связывающих электронов)/2- количество неподеленных пар электронов
Отсюда формальный заряд на карбонильном атоме С в Ch4cooh=4-8/2-0=0.
Формальный заряд на карбонильном атоме О в Ch4cooh=6-4/2-4=0.
Формальный заряд на атоме О группы –ОН=6-4/2-4=0.
Формальный заряд на атоме С группы –ch4=4-8/2-0=0.
Следовательно, формальный заряд центрального атома C равен 0. Каждый атом в Ch4cooh имеет формальный заряд 0, что делает все соединение электрически нейтральным.
В Ch4cooh структура льюиса, карбонильный углерод использует sp2-гибридную орбиталь для образования связей с группой –ch4 и группой –OH, т.е. угол CCO равен 1200. Атом углерода в группе –Ch4 находится в sp3-гибридизации, т.е. угол HCH должен быть 109.280.
Карбонил O такой же, как карбонильный углерод, который гибридизован sp2 (т.е. 1200), а также атом O группы –OH находится в состоянии sp3-гибридизации (т.е. 109.280). Поскольку центральный атом в Ch4cooh имеет номер 120.0 угол, общий состав планировщик.
Ch4cooh Структура Льюиса Правило октетаIn Ch4cooh структура льюиса мы видим, что все атомы выполнили свой октет. Группа C группы ch4 образует 3 связи с атомом H и 1 связь с группой C=O.
Карбонильный углерод образует 1σ- и 1∏-связь с атомом O, а также образует 2 σ-связи с -ch4 и группой –OH. Карбонил O образует двойную связь с атомом C и также содержит 2 неподеленные пары. Атом O группы –OH образует 2 σ-связи с группой C=O и 1 атом H. Отсюда мы видим, что все атомы удовлетворяют правилу октетов, за исключением H, которые удовлетворяют правилу дублетов.
Атом O группы –OH образует 2 σ-связи с группой C=O и 1 атом H. Отсюда мы видим, что все атомы удовлетворяют правилу октетов, за исключением H, которые удовлетворяют правилу дублетов.
Неподеленные электронные пары — это валентные электроны, которые не являются общими для двух атомов, когда они связаны ковалентной связью. Она также известна как несвязывающая электронная пара.
Формула, с помощью которой мы можем вычислить неподеленную пару электронов на данном атоме Ch4cooh, изображена ниже:
Неподеленные электронные пары атома = электроны, присутствующие на валентной оболочке атома, — сколько связей образует этот атом.
неподеленная электронная пара, присутствующая на атоме O группы C = O в уксусной кислоте = 6-2=4 т.е. 2 неподеленные пары электронов.
Неподеленная электронная пара присутствует на атоме O группы –OH в Ch4cooh=6-2=4, т.е. 2 неподеленные электронные пары.
Неподеленная пара электронов, присутствующая на атоме C группы –C=O= 4-4=0, то есть несвязывающие электронные пары.
Эти неподеленные электронные пары показаны на структура льюиса Ch4cooh на атомах C, H, O в виде электронных точек.
Ch4cooh Валанс ЭлектронсЧтобы узнать общее количество валентных электронов в Ch4cooh, необходимо знать, сколько валентных электронов присутствует в атомах C, H и кислорода. C имеет электронную конфигурацию 1s2 2s2 2p2, а электронная конфигурация атома C показывает, что существует 4 электрона.
Атом кислорода имеет электронную конфигурацию 1s2 2s2 2p4, то есть в атоме O существует 6 валентных электронов, а H имеет только 1 валентный электрон. Ch4cooh содержит общий валентный электрон, который будет равен сумме всех валентных электронов C, O и H. атомы. Следовательно, в Ch4cooh присутствует (4*2)+(2*6)+(4*1)=24 валентных электрона.
Гибридизация Ch4coohГибридизация означает, что центральный атом смешивает свои атомные орбитали, такие как s, p, d, которые находятся в различном энергетическом состоянии, для получения аналогичных энергетических гибридных орбиталей, например, sp2, sp3, sp3d и т. д. Электронная конфигурация атома C 2s2 2p2 в основном энергетическом состоянии. Мы обнаружили, что в валентной оболочке атома C присутствуют только 2 неспаренных электрона, а для образования Ch4cooh требуется 4 неспаренных электрона.
д. Электронная конфигурация атома C 2s2 2p2 в основном энергетическом состоянии. Мы обнаружили, что в валентной оболочке атома C присутствуют только 2 неспаренных электрона, а для образования Ch4cooh требуется 4 неспаренных электрона.
При подаче энергии 1 2s электронов переходит на вакантную 2p-орбиталь, образуя в общей сложности 4 неспаренных электрона в валентной оболочке атома C. На следующем этапе 1 атом O группы –OH, атом C группы –Ch4 и еще один атом O отдают свой 1 неспаренный электрон с образованием связей C-Ch4, C-OH и CO. Атом O отдает свой оставшийся неспаренный электрон для образования связи C=O (pi).
В этом соединении центральный C использует гибридную орбиталь sp2 для образования этих связей. Согласно гибридизации sp2, геометрия Ch4cooh будет планирующей.
Гибридизация Ch4coohРастворимость Ch4coohПоскольку Ch4cooh полярен по своей природе, он растворяется в полярных растворителях, таких как вода, этанол, метанол др. Хорошо растворим в полярных растворителях. Поскольку Ch4cooh имеет кислую природу, он реагирует с водными растворами щелочей, происходит реакция нейтрализации с образованием воды и ацетатных солей. При растворении в воде Ch4cooh диссоциирует в воде с образованием ионов Ch4coo- и H+.
Хорошо растворим в полярных растворителях. Поскольку Ch4cooh имеет кислую природу, он реагирует с водными растворами щелочей, происходит реакция нейтрализации с образованием воды и ацетатных солей. При растворении в воде Ch4cooh диссоциирует в воде с образованием ионов Ch4coo- и H+.
Ch4cooh представляет собой ионное соединение. Это связано с тем, что при разложении ch4cooh образуются ацетат и ион H+. Когда к уксусной кислоте добавляют воду, она легко растворяется и водн. раствор Ch4cooh проводит электричество, так как существуют ионы, подобные ионному соединению.
Уксусная кислота имеет высокую температуру кипения, как и другие ионные соединения. 2 Молекулы Ch4cooh димеризуются за счет внутримолекулярных Н-связей, для их разделения требуется большое количество энергии. Это ясно указывало на то, что Ch4cooh имеет ионную природу.
Является ли Ch4cooh кислотным или основным?Ch4cooh является кислотным соединением. Это связано с наличием группы cooh. В водном растворе дает ион H+ и ион ch4coo-. Подобно кислому соединению, он реагирует с основаниями с образованием воды и соли. Уксусная кислота реагирует с основанием подобно NaoH, образуя воду и ацетат натрия (ch4ccoNa).
Это связано с наличием группы cooh. В водном растворе дает ион H+ и ион ch4coo-. Подобно кислому соединению, он реагирует с основаниями с образованием воды и соли. Уксусная кислота реагирует с основанием подобно NaoH, образуя воду и ацетат натрия (ch4ccoNa).
Ch4cooh полярен по своей природе. Соединение называется полярным, если его дипольный момент не равен нулю. В этом соединении из-за наличия карбонильной группы момент связи С=О направлен к атому кислорода.
В ch4cooh неподеленная пара на атоме O группы -OH делокализована с ∏* разрыхляющей орбиталью группы C=O, и для этого полюс –ve создается на карбонильном атоме O, а полюс +ve создается на атоме кислорода группы OH. Следовательно, происходит разделение заряда. Вот почему ch4ccoh полярен по своей природе.
Является ли Ch4cooh линейным или тетраэдрическим?Ch4cooh имеет планировочную форму с sp2-гибридизацией центрального атома C. Он не является линейным или тетраэдрическим по своей природе.
Он не является линейным или тетраэдрическим по своей природе.
Принимая во внимание обсуждаемые выше факты, мы заключаем, что уксусная кислота представляет собой полярное ионное соединение, в котором карбонил C использует sp2-гибридную орбиталь, что делает составной планировщик. Его ПКa низкая, так что это слабая кислота, а также имеет тенденцию образовывать воду и соли всякий раз, когда реагирует с основаниями. Ch4cooh является стабильным соединением благодаря резонансу.
Определить валентность элементов по формуле hc1 ph4 cl2 of feb o3
Химия, 11.08.2019 14:30, Husky333
Посмотреть ответы
Другие вопросы по: Химия
Всредние века цивилизации существовали во всех частях света,…
Опубликовано: 27.02.2019 05:30
Ответов: 2
Через терминал оплаты на мобильный телефон можно перевести деньги, при этом взимается комиссия – целое положительное число процентов. при переводе некоторой целочисленной суммы ден…
при переводе некоторой целочисленной суммы ден…
Опубликовано: 01.03.2019 12:10
Ответов: 1
Выражение 4а+90а 86в+77в 209м+м 302n-n…
Опубликовано: 01.03.2019 12:20
Ответов: 1
Нужно написать эссе (200-250 слов) на тему нужны ли телепередачи в современном мире? ? аргументы нужны и почему не нужны….
Опубликовано: 01.03.2019 20:30
Ответов: 1
Что общего между произведением н. а. некрасова «на волге» и картиной и. е. репина » бурлаки на волге» ? ответьте**)…
Опубликовано: 01.03.2019 22:40
Ответов: 2
X(в кубе)y+xy(в кубе) при x-y=4 а xy=3…
Опубликовано: 02.03.2019 01:30
Ответов: 1
Знаешь правильный ответ?
Определить валентность элементов по формуле hc1 ph4 cl2 of feb o3…
Популярные вопросы
.(Две машинистки перепечатали рукопись за 12 часов. сколько времени потребовалось бы второй машинистке на перепечатку этой рукописи, если она может выполнить всю работу на 7 часов…
сколько времени потребовалось бы второй машинистке на перепечатку этой рукописи, если она может выполнить всю работу на 7 часов…
Опубликовано: 28.02.2019 05:30
Ответов: 2
Вагон массой 30т, движущийся горизонтально со скоростью 1,5м/с, автоматически на ходу сцепляется с неподвижным вагоном массой 20т. с какой скоростью движется сцепка?…
Опубликовано: 01.03.2019 12:00
Ответов: 2
1.найдите длину окружности, диаметр которого равен 8см. ответ округлите до десятых.(число пи = 3,14. а) 25,2см б) 25,1см в) 12,6см г) другой ответ 2.найти площадь окружности, радиу…
Опубликовано: 02.03.2019 18:10
Ответов: 3
5метров-5 сантиметров= 5метров6дециметров-8дециметров= 5метроа6сантиметров-8сантиметров…
Опубликовано: 03.03.2019 13:40
Ответов: 3
2c17h45cooh+ca(oh)2=(c17h45cooh)2ca +2h3o определить массу осадка получаемого в рез. взаимодействия 50 г. стеариновой к-ты c17h45cooh с гидроксидом кальция….
взаимодействия 50 г. стеариновой к-ты c17h45cooh с гидроксидом кальция….
Опубликовано: 03.03.2019 16:10
Ответов: 1
Хв 3 степени -9х во вторй степени + 20х=0…
Опубликовано: 03.03.2019 16:50
Ответов: 2
Al + hcl, na2o+h4po4, zno+h3so4, mg+h3so4, fe2o3+hcl, bao+hno3…
Опубликовано: 03.03.2019 17:50
Ответов: 2
Коля узнал, что 45 больших деревьев растущих в лесу выделяют в сутки столько кислорода, сколько его нужно для дыхания 90 третьеклассников. в большом городе много загрязняющих его г…
Опубликовано: 03.03.2019 18:30
Ответов: 3
Узнай, кому и как благотворители. объясни, может ли благотворительность исправить чужую жизнь….
Опубликовано: 04.03.2019 00:50
Ответов: 3
Представьте выражение в виде квадрата двучлена: 1) 1-4xy+4x^2y^2 2) 1/4а^2b^2+ab+1 объясните как решать. ..
..
Опубликовано: 04.03.2019 01:00
Ответов: 1
Больше вопросов по предмету: Химия Случайные вопросы
Популярные вопросы
Ch4COOH структура льюиса, молекулярная геометрия, полярность, гибридизация
Главная > Химия > Уксусная кислота ( Ch4COOH) структура льюиса и четыре атома водорода с химической формулой Ch4COOH. Это слабая кислота, также известная как этановая кислота, выглядит как бесцветная жидкость и имеет запах, напоминающий густой уксус. Он вызывает коррозию металлов и тканей.
В этой статье мы обсудим структуру Льюиса уксусной кислоты (Ch4COOH), гибридизацию, полярность или неполярность, геометрию и т. д.
Длительное воздействие уксусной кислоты может вызвать сильное раздражение глаз, кожи, носа, горла и т. д., а также в других частях тела. Уксусная кислота становится легковоспламеняющейся и взрывоопасной при температуре выше 40ºC. Уксусная кислота существует в виде полярного или протонного растворителя в жидкой форме.
Уксусная кислота существует в виде полярного или протонного растворителя в жидкой форме.
| Название молекулы | Acetic acid |
| Chemical formula | Ch4COOH |
| Molecular geometry or shape | Trigonal planar and Tetrahedral |
| Hybridization | Sp³ – Sp 2 |
| Природа | Полярная молекула |
| Сумма валентных электронов для Ch4COOH | 24 |
| Дипольный момент | 1,74 D |

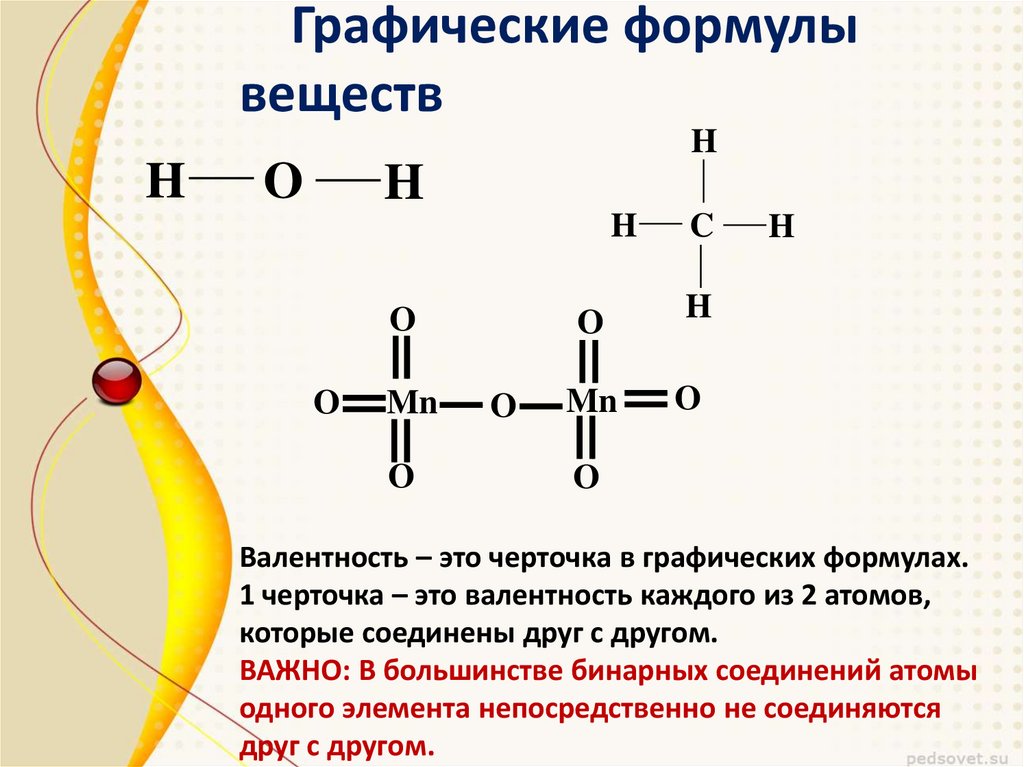
Структуру Льюиса Ch4COOH нарисовать не так сложно, как вы думаете. Нам нужен только хороший подход, чтобы нарисовать диаграмму Льюиса любой молекулы, неважно, простая она или сложная.
Теперь мы шаг за шагом нарисуем структуру Льюиса уксусной кислоты со всеми возможными пояснениями.
Выполните несколько шагов для построения структуры точек Льюиса Ch4COOH (уксусной кислоты) или валентные электроны расположены в молекуле. Итак, первый шаг построения диаграммы Льюиса любой молекулы — определить валентный электрон, присутствующий в молекуле.Валентные электроны — это электроны, находящиеся на внешней оболочке атома. Чтобы найти валентный электрон в молекуле Ch4COOH, достаточно взглянуть на их периодические группы из атомов.
Так как углерод относится к 14-й периодической группе, кислород к 16-й, а водород присутствует в 1-й группе периодической таблицы. Следовательно, валентный электрон для углерода равен 4, для кислорода — 6, а для водорода — 1.
⇒ Общее количество валентных электронов в углероде = 4
⇒ Общее количество валентных электронов в кислороде = 6
⇒ Общее количество валентных электронов в водороде = 1
∴ Общее количество валентных электронов, доступных для 4 CHCOOH (2) + 6(2) + 1(4) = 24 валентных электрона [молекула ∴Ch4COOH содержит два атома углерода, два кислорода и 4 водорода]
2. Найдите наименее электроотрицательный атом и поместите его в центр
Поскольку менее электроотрицательные атомы более склонны делиться большим количеством электронов с окружающими атомами, следовательно, на диаграмме Льюиса наименее электроотрицательный атом всегда занимает место центрального положения.
В молекуле Ch4COOH присутствуют три типа атомов – водород, кислород и углерод. Следует отметить, что на диаграмме Льюиса атома водорода всегда выходят за пределы означает, что они всегда занимают место окружающего положения, независимо от ситуации.
Это связано с тем, что водород может удерживать только два валентных электрона на своих внешних оболочках.
Из углерода и кислорода атом углерода ( 2,55 ) менее электроотрицателен, чем атом кислорода ( 3,44 ), поэтому углерод занимает центральное положение на диаграмме Льюиса.
Вам интересно, как мы размещаем эти атомы в случайном порядке в приведенной выше структуре? Молекула Ch4COOH содержит функциональную группу, которую также называют карбоксильной группой (COOH). Эта группа всегда работает вместе в структуре.
Функциональная группа в органической химии – это совокупность атомов внутри молекул, которые связываются друг с другом, реагируя предсказуемым образом.
Следовательно, в приведенной выше структуре атомы группы СООН расположены вместе, тогда как водород всегда выходит наружу на диаграмме Льюиса.
3. Соединить внешние атомы с центральным атомом одинарной связью
Здесь мы соединяем все окружающие атомы с центральным атомом одинарной связью. Итак, просто соедините все внешние атомы (водород и кислород) с центральным атомом (углеродом), используя одинарную связь.
Итак, просто соедините все внешние атомы (водород и кислород) с центральным атомом (углеродом), используя одинарную связь.
Примечание – функциональная группа COOH будет работать вместе.
Теперь просто начните считать валентный электрон, который мы использовали в приведенной выше структуре. Одинарная связь означает два валентных электрона. В приведенной выше структуре 7 одинарных связей используются для соединения окружающих атомов с центральным положением.
Следовательно, 7 × 2 = 14 валентных электрона используются в приведенной выше структуре из общего количества 24 валентных электронов, доступных для Ch4COOH.
∴ (24 – 14) = 10 валентных электронов
Следовательно, у нас осталось на 10 валентных электронов больше.
4. Поместите сначала оставшиеся валентные электроны, начиная с внешнего атома
На этом шаге нам нужно заполнить октет внешних атомов (водород и кислород), поместив оставшийся валентный электрон, который у нас есть. «Октет означает наличие 8 валентных электронов на внешней оболочке атома».
«Октет означает наличие 8 валентных электронов на внешней оболочке атома».
Атом водорода является исключением из правила октетов, поскольку ему нужно всего два электрона, чтобы заполнить самую внешнюю оболочку.
Как вы видите в приведенной выше структуре, у нас было 10 оставшихся валентных электрона, и мы поместили их все на внешний атом кислорода, чтобы выполнить их октет, поскольку все атомы водорода уже имеют два электрона в своей валентной оболочке из-за одинарная связь.
Таким образом, каждый атом кислорода имеет вокруг себя 8 валентных электрона, а каждый атом водорода имеет 2 , следовательно, эти атомы комфортно завершили свой октет.
Давайте перейдем к следующему шагу, чтобы также завершить октет центрального атома.
5. Завершите октет центрального атома и при необходимости создайте ковалентную связь
Поскольку мы уже завершили октет внешнего атома в приведенной выше структуре, теперь нам нужно завершить октет центрального атома (углерода).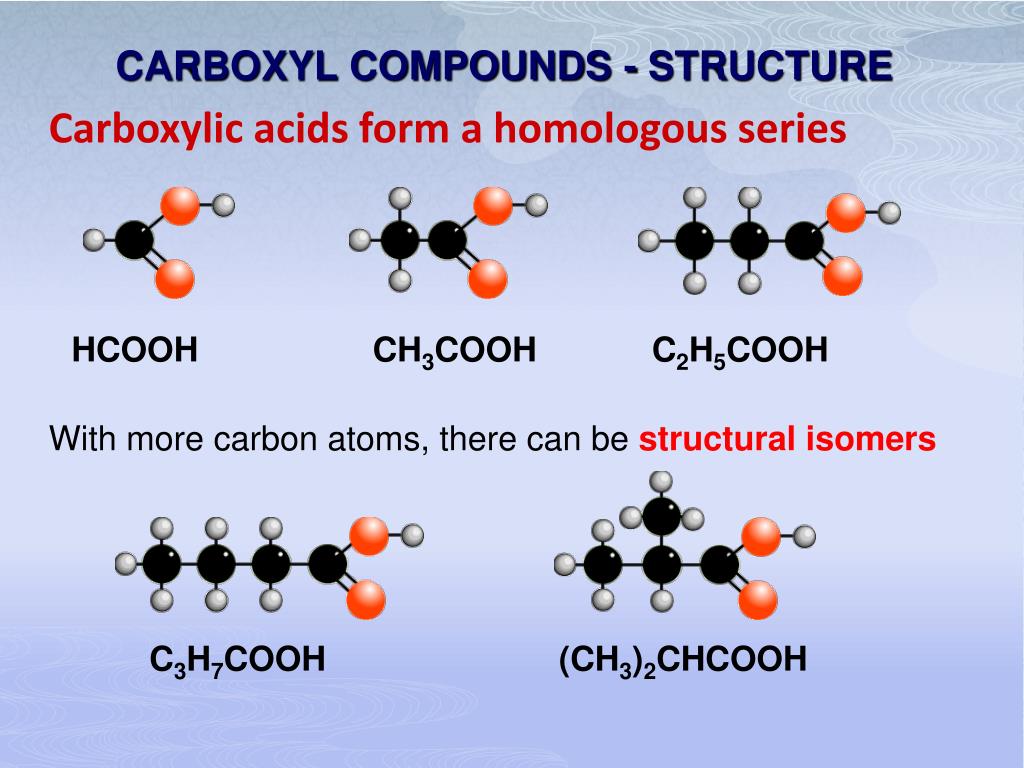 Углероду нужно 8 электронов на внешней оболочке, чтобы получить октет.
Углероду нужно 8 электронов на внешней оболочке, чтобы получить октет.
Если вы видите 4-ю ступенчатую структуру , левый углерод уже завершил свой октет, поскольку он присоединен к 4 одинарным связям, которые разделяют 8 электронов. Но правый углерод имеет только 3 одинарные связи, которые содержат 6 электронов.
Следовательно, нам нужно еще два электрона, чтобы удовлетворить спрос на правый углерод. Но у нас нет оставшихся валентных электронов, так как мы уже использовали их все в структуре 4-й ступени.
Таким образом, в этих случаях мы преобразуем неподеленную пару в ковалентную связь, не нарушая октета ни одного атома.
Как видно из приведенной выше структуры, мы превращаем одну неподеленную пару электронов кислорода в ковалентную связь, не нарушая правила октета.
Глядя на вышеприведенную структуру, мы видим, что наш правый углерод удобно завершает октет, и атом кислорода, который мы взяли за одну неподеленную пару, чтобы преобразовать в ковалентную связь, также достиг октета.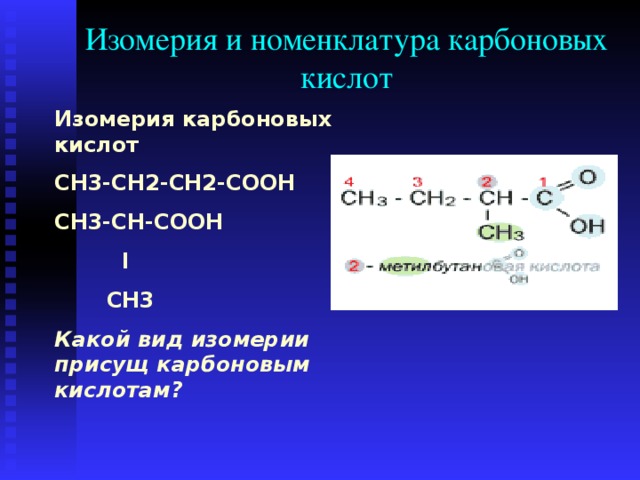
Следовательно, все атомы в приведенной выше структуре имеют свой октет, так что, можно сказать, мы получили нашу структуру Льюиса Ch4COOH.
Мы определили структуру Льюиса уксусной кислоты, но нам нужно было проверить ее стабильность с помощью концепции формального заряда.
6. Проверить устойчивость с помощью концепции формального заряда
Как известно, чем меньше формальные заряды на атоме, тем лучше устойчивость диаграммы Льюиса.
Мы рассчитаем формальную плату по 5-й ступени структуры .
⇒ Формула формального заряда = (валентные электроны – электроны неподеленной пары – электроны 1/2 связанной пары)
Все атомы водорода на диаграмме Льюиса Ch4COOH имеют нулевые формальные заряды, просто посчитайте F.C. по атомам углерода и кислорода.
Оба атома углерода присоединены к 4 одинарным связям и к нулю неподеленных пар на нем, следовательно, их формальный заряд также будет одинаковым, так что просто посчитайте F. C. на один атом углерода
C. на один атом углерода
Для атома углерода-
- Валентный электрон углерода = 4
- Неподеленная пара электронов на углероде = 0
- Связанная пара электронов вокруг углерода = 8 (4 одинарных связи)
- Валентный электрон кислорода = 6
- Неподеленная пара электронов на кислороде = 4
- Связанная пара электронов вокруг кислорода = 4
- Калькулятор формального начисления
- Калькулятор структуры Льюиса
- Как нарисовать структуру Льюиса?
- Как определить, является ли молекула полярной или неполярной?
- CH 2 Cl 2 lewis structure and its molecular geometry
- CHCl 3 lewis structure and its molecular geometry
- CH 2 O Структура Lewis и ее молекулярная геометрия
- CH 4 Структура Льюиса и его молекулярная геометрия
- Расширение98
- Расширение8
- . Структура Льюиса равна 24.
- Структура Льюиса Ch4COOH состоит из 3 связей C-H, 1 C-C, 1 O-H, 1 C-O и 1 связи C=O.
- Гибридизация углерода (C 1 ) представляет собой Sp 3 и углерод (C 2 ) Sp 2 .

- Ch4COOH является полярной молекулой в природе из-за неравномерного распределения заряда на атоме, что приводит к некоторому результирующему дипольному моменту.
- В структуре Льюиса уксусной кислоты 3 связи C-H, 1 C=O. связь, 1 связь СО, 1 связь ОН и 1 связь С-С.
- Ch4COOH имеет два типа молекулярной геометрии или формы – треугольную плоскую и тетраэдрическую геометрию.
- Всего в структуре Льюиса Ch4COOH присутствует 8 неподеленных пар электронов и 16 связанных пар электронов.
Чертеж и подробные пояснения – Lambda Geeks
В этой статье мы познакомимся со структурой Льюиса уксусной кислоты.
Уксусная кислота имеет химическую формулу CH 3 COOH и представляет собой простую органическую или монокарбоновую кислоту, состоящую из двух атомов углерода, двух атомов кислорода и четырех атомов водорода. Это слабая кислота, также известная как этановая кислота, которая представляет собой белую жидкость с сильным запахом уксуса.
Как построить точечную структуру Льюиса CH 3 COOH поэтапно (уксусная кислота): Разъедает как металлы, так и ткани.
Разъедает как металлы, так и ткани. Длительное воздействие уксусной кислоты может вызвать серьезное раздражение глаз, кожи, носа, горла и других частей тела, среди прочего. Когда уксусная кислота достигает 40 градусов по Цельсию, она становится легковоспламеняющейся и взрывоопасной. В жидком состоянии уксусная кислота является полярным или протонным растворителем.
Структура Льюиса или структура электронных точек уксусной кислоты (Ch4COOH) будет обсуждаться в этой статье.
В структуре Льюиса Ch4COOH функциональная группа (COOH) содержит одну двойную связь, четыре неподеленные пары на окружающих атомах и восемь связанных пар, которые соединяют один атом с другим.
1. Определите общее количество валентных электронов в CH 3 COOHСтруктура Льюиса, также известная как структура электронных точек, помогает понять, как атомы или валентные электроны группируются в молекуле.
 В результате первым шагом при построении диаграммы Льюиса для каждой молекулы является определение количества присутствующих валентных электронов.
В результате первым шагом при построении диаграммы Льюиса для каждой молекулы является определение количества присутствующих валентных электронов.Валентные электроны — это электроны, находящиеся во внешней оболочке атома. Просто посмотрите на периодическую группу атомов в молекуле CH 3 COOH, чтобы определить валентный электрон.
Поскольку углерод находится в 14-й периодической группе, кислород — в 16-й, а водород — в первой группе периодической таблицы, в результате валентный электрон углерода равен 4, валентный электрон кислорода равен 6 и валентный электрон водорода равен 1,
- В углероде общее число валентных электронов равно 4,9.0286
- В кислороде общее число валентных электронов равно 6.
- В водороде общее число валентных электронов равно одному.
Общее число валентных электронов, доступных для структуры Льюиса Ch4COOH = 4(2) + 6(2) + 1(4) = 24 валентных электрона [молекула CH 3 COOH состоит из двух атомов углерода, двух атомов кислорода и четыре атома водорода].
2. Найдите атом с наименьшим электроотрицательным зарядом и поместите его в середину
Поскольку менее электроотрицательные атомы с большей вероятностью обмениваются электронами с соседними атомами, наименее электроотрицательный атом всегда занимает среднее положение на диаграмме Льюиса.
Молекула CH 3 COOH содержит три различных типа атомов: водород, кислород и углерод. Стоит отметить, что на диаграмме Льюиса атомы водорода всегда перемещаются наружу, а это означает, что они всегда занимают окружающее пространство, независимо от сценария.
Это связано с тем, что на самых внешних оболочках водород может сохранять только два валентных электрона.
Поскольку атом углерода имеет меньший электроотрицательный заряд, чем атом кислорода, он занимает среднее положение на диаграмме Льюиса.
Карбоксильная группа представляет собой функциональную группу, обнаруженную в молекуле CH 3 COOH (COOH). Эта группа постоянно работает структурированным образом.
3. Используйте одинарную связь для соединения внешних атомов с атомом ядра В результате атомы группы СООН расположены вместе в вышеупомянутой структуре, тогда как водород всегда расположен снаружи на диаграмме Льюиса.
В результате атомы группы СООН расположены вместе в вышеупомянутой структуре, тогда как водород всегда расположен снаружи на диаграмме Льюиса.Единая связь соединяет все окружающие атомы с атомом ядра. Просто используйте одинарную связь, чтобы соединить все внешние атомы (водород и кислород) с центральным атомом (углеродом). Просто начните считать валентные электроны, которые мы использовали в приведенной выше структуре. Два валентных электрона образуют одинарную связь. Семь одинарных связей используются для соединения окружающих атомов с центральной точкой в вышеупомянутой структуре.
Из 24 валентных электронов, доступных для CH 3 COOH, 7×2 = 14 валентных электронов используются в вышеуказанной структуре.
(10 валентных электронов) = (24 – 14), В результате имеем лишние десять валентных электронов.
4. Начиная с внешнего атома, поместите оставшиеся валентные электроныМы используем оставшийся валентный электрон, чтобы завершить октет внешних атомов в этой точке (водород и кислород).
Источник изображения из Википедии «Октет определяется как атом с восемью валентными электронами во внешней оболочке». Только электронные пары могут быть идентифицированы в самой внешней оболочке атома водорода, что делает его исключением из правила октета.
«Октет определяется как атом с восемью валентными электронами во внешней оболочке». Только электронные пары могут быть идентифицированы в самой внешней оболочке атома водорода, что делает его исключением из правила октета.Хотя все атомы водорода уже имеют два электрона в своей валентной оболочке, вызванной единственной связью, мы помещаем все 10 оставшихся валентных электронов на внешний атом кислорода, чтобы завершить их октет, как показано на диаграмме выше. Поскольку каждый атом кислорода имеет 8 валентных электронов, а каждый атом водорода — 2, эти атомы легко завершают свой октет.
5. Завершить октет основного атома и, при необходимости, сформировать ковалентную связьВ предыдущей структуре мы уже закончили октет внешнего атома; теперь мы должны завершить октет внутреннего атома (углерода). Для достижения октета углероду требуется 8 электронов на внешней оболочке.
Глядя на структуру четвертой ступени, вы можете видеть, что левый углерод уже завершил свой октет, потому что он связан с четырьмя одинарными связями, которые имеют восемь общих электронов.

- Расширение8
F,C
. на атоме углерода
= (4 – 0 – 8/2) = 0Оба атома кислорода присоединены к 2 одинарным связям и оба содержат 2 неподеленные пары. Следовательно, их формальное обвинение также будет одинаковым. Итак, просто посчитайте F.C. на один атом кислорода.
Для атома кислорода-
∴ F.C. на атоме кислорода = (6 – 4 – 4/2) = 0
Таким образом, все атомы в структуре Льюиса Ch4COOH имеют нулевой формальный заряд-
Уксусная кислота (Ch4COOH) структура Льюиса , приведенная выше структура Льюиса уксусной кислоты (Ch4COOH) является лучшей и наиболее стабильной, поскольку все атомы имеют формальный нулевой заряд.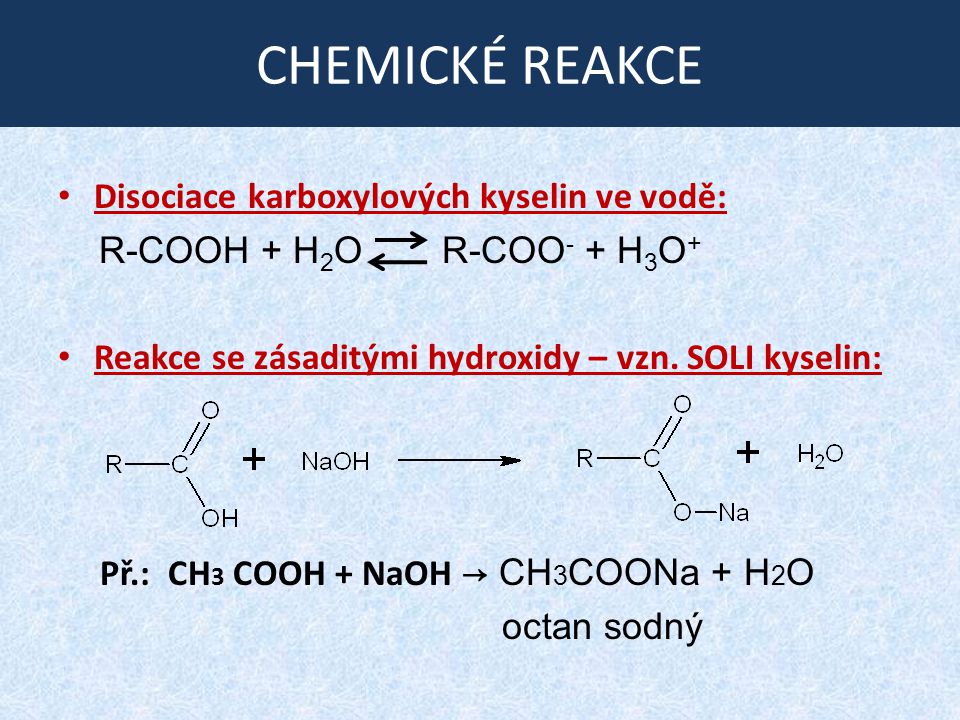
Также проверьте –
Я очень надеюсь, что вам понравилась процедура построения диаграммы Льюиса со всеми понятиями и возможными объяснениями.
Какова молекулярная геометрия Ch4COOH?Используя теорию VSEPR и ее схему, мы можем легко определить форму или геометрию Ch4COOH. «Молекулярная геометрия — это трехмерное расположение атомов внутри молекулы».
Вот простая структура Ch4COOH –
Мы найдем молекулярную и электронную геометрию Ch4COOH вокруг обоих атомов углерода (C 1 и C 2 ).
⇒ Углерод (C 1 )
Углерод 1 напрямую связан с тремя атомами водорода и одним атомом углерода с правой стороны, он не содержит неподеленной пары. Следовательно, согласно теории VSEPR, этот углерод 1 поддерживает электронную и молекулярную геометрию тетраэдра. Он имеет AX 4 общая формула.
Он имеет AX 4 общая формула.
⇒ Углерод (C 2 )
Углерод 2 присоединен только к трем атомам и также не содержит ни одной неподеленной пары электронов, следовательно, согласно теории VSEPR, этот атом сохраняет электронную и молекулярную геометрию тригональной плоскости. Он имеет общую формулу AX 3 .
Гибридизация Ch4COOHСогласно гибридизации, «две или более орбиталей перекрывают друг друга и образуют две или более гибридные орбитали, которые имеют одинаковую энергию и форму».
Чтобы определить гибридизацию любой молекулы, мы должны сначала определить число гибридизации или стерическое число центрального атома.
В случае молекулы Ch4COOH гибридизуются два атома углерода (C 1 и C 2 ).
⇒ Углерод (C 1 )
Этот первый атом углерода соединен с тремя атомами водорода и одним углеродом с правой стороны, поэтому общее количество присоединенных атомов равно четырем, и он не содержит неподеленных пар.
Стерическое число углерода (C 1 ) = 4 + 0
= 4
∴ для стерического числа 4 получаем Sp 7 8PR 3 9005 по теории гибридизации.
⇒ Углерод (C 2 )
Углерод 2 принадлежит к карбоксильной функциональной группе, которая присоединена к 3 атомам, а также не содержит неподеленной пары электронов.
Стерическое число углерода (C 2 ) = 3 + 0
= 3
∴ ∴ для стерического числа 3 получаем Sp 2 гибридизация по теории ВСЕПР.
| Steric number | Hybridization |
| 1 | S |
| 2 | Sp |
| 3 | Sp² |
| 4 | Sp³ |
| 5 | Сп³d |
| 6 | Sp³d² |
∴ Связь С-С в структуре Ch4COOH образована перекрыванием Sp 3 – Sp 2 Уксусная кислота (Ch4COOH) представляет собой полярную молекулу , поскольку она содержит кислород с двойной связью, который является более электроотрицательным, чем атом углерода, поэтому разница электроотрицательности атомов углерода и кислорода создает дипольный момент в C-O связь из-за наведения на них положительного и отрицательного заряда. Кроме того, если посмотреть на диаграмму Льюиса уксусной кислоты, ее структура не кажется симметричной, что означает, что она имеет неравное или несимметричное распределение валентных электронов. Это неравномерное распределение заряда создает суммарный дипольный момент, который делает молекулу Ch4COOH полярной по своей природе. Уксусная кислота имеет чистый дипольный момент 1,74 D , что близко к воде, поэтому она легко образует водородные связи в воде, что показывает ее истинную полярную природу. Также проверьте- ⇒ Общее число валентных электронов в углероде = 4 ⇒ Общее количество валентных электронов в кислороде = 6 ⇒ Общее количество валентных электронов в водороде = 1 ∴ Общее количество валентных электронов, доступных для структуры Льюиса Ch4COOH = 4(2) + 6(2) + 1(4) = 24 валентных электрона. В соответствии со структурой Льюиса Ch4COOH имеется в общей сложности 8 электронов неподеленной пары, которые расположены вокруг обоих атомов кислорода. А общая связанная пара электронов в структуре Льюиса уксусной кислоты (Ch4COOH) равна 16 (8 одинарных связей). Электроны связанной пары — это общие электроны, которые принимают участие в химической связи, тогда как электроны неподеленной пары — это неподеленные электроны. Also Read: .  Полярность уксусной кислоты: Ch4COOH полярен или неполярен?
Полярность уксусной кислоты: Ch4COOH полярен или неполярен? 
Часто задаваемые вопросы Сколько валентных электронов присутствует в структуре Льюиса Ch4COOH? Сколько неподеленных пар и пар связей присутствует в структуре Льюиса Ch4COOH? 
Сумма

 Разъедает как металлы, так и ткани.
Разъедает как металлы, так и ткани. 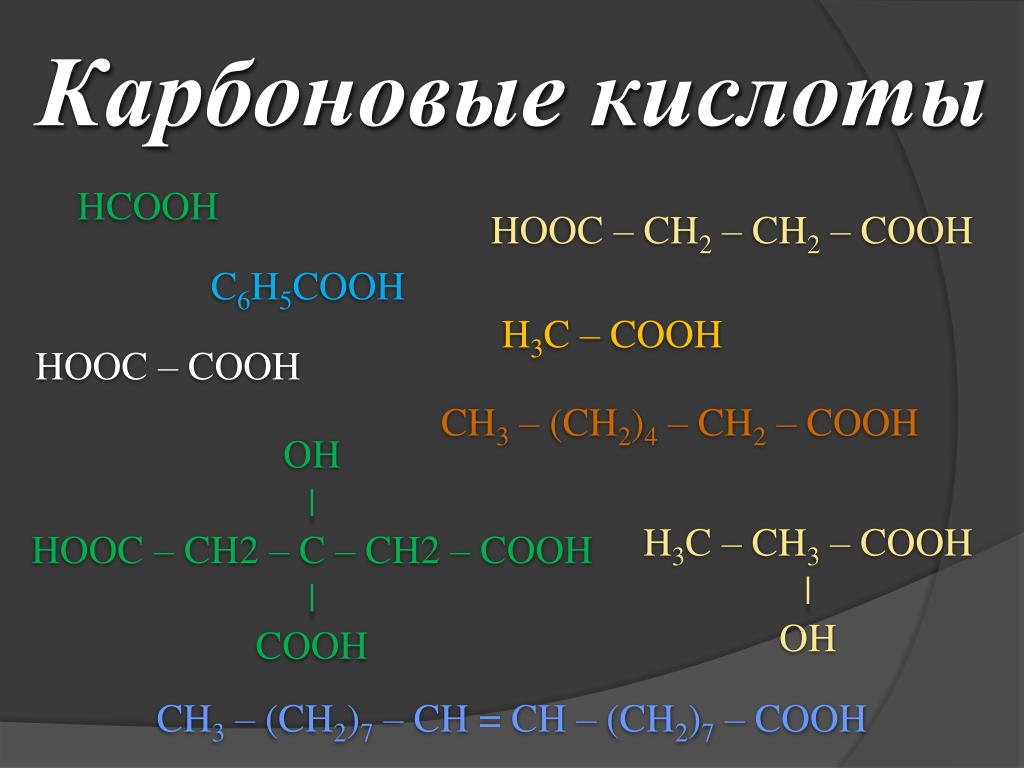 В результате первым шагом при построении диаграммы Льюиса для каждой молекулы является определение количества присутствующих валентных электронов.
В результате первым шагом при построении диаграммы Льюиса для каждой молекулы является определение количества присутствующих валентных электронов.
 В результате атомы группы СООН расположены вместе в вышеупомянутой структуре, тогда как водород всегда расположен снаружи на диаграмме Льюиса.
В результате атомы группы СООН расположены вместе в вышеупомянутой структуре, тогда как водород всегда расположен снаружи на диаграмме Льюиса. «Октет определяется как атом с восемью валентными электронами во внешней оболочке». Только электронные пары могут быть идентифицированы в самой внешней оболочке атома водорода, что делает его исключением из правила октета.
«Октет определяется как атом с восемью валентными электронами во внешней оболочке». Только электронные пары могут быть идентифицированы в самой внешней оболочке атома водорода, что делает его исключением из правила октета.