рисунки, гибридизация, форма, заряды, пары
В этой статье мы обсуждаем Mg3N2 Структура Льюиса и все другие факты, такие как ее гибридизация, валентные электроны.
Mg3N2 , нитрид магния представляет собой порошок желтого цвета при комнатной температуре. Это соединение, содержащее магний и азот.
Как нарисовать мг3N2 структуры Льюиса?В магнии существует 2 валентных электрона, а в азоте — 5. Здесь 3 атома магния и 2 атома азота. 3 атома Mg делят свои 2 валентные электроны к двум присутствующим атомам азота с образованием ионного соединения. Когда Mg делит свои 2 электрона, он становится положительно заряженным Mg.2+ ион.
Азот принимает 3 электрона от 2 атомов Mg и становится отрицательно заряженным, N3-ион. Таким образом, положительно заряженный Mg2+ и отрицательно заряженный N3- притягиваются друг к другу и образуют ионную связь. Итак структура льюиса Mg3N2 можно изобразить как
Итак структура льюиса Mg3N2 можно изобразить как
Формальный заряд каждого атома в соединении Mg3N2 (Нитрид магния) можно определить с помощью простого уравнения.
Формальный заряд атома = количество валентных электронов — количество неподеленной пары электронов — количество образованных связей
Здесь формальный заряд каждого атома в Mg3N2 может быть найден.
Формальный заряд Mg = 2 – 0 -2
= 0
Формальный заряд азота = 5 -2 – 3
= 0
Таким образом, общий заряд Mg3N2 оказывается 0.
Mg3N2 Правило октета| K | L | M | N | ||
| магниевый | 2 | 8 | 2 | ||
| Азот | 2 | 5 |
Здесь азоту нужно еще 3 электрона, чтобы выполнить свой октет.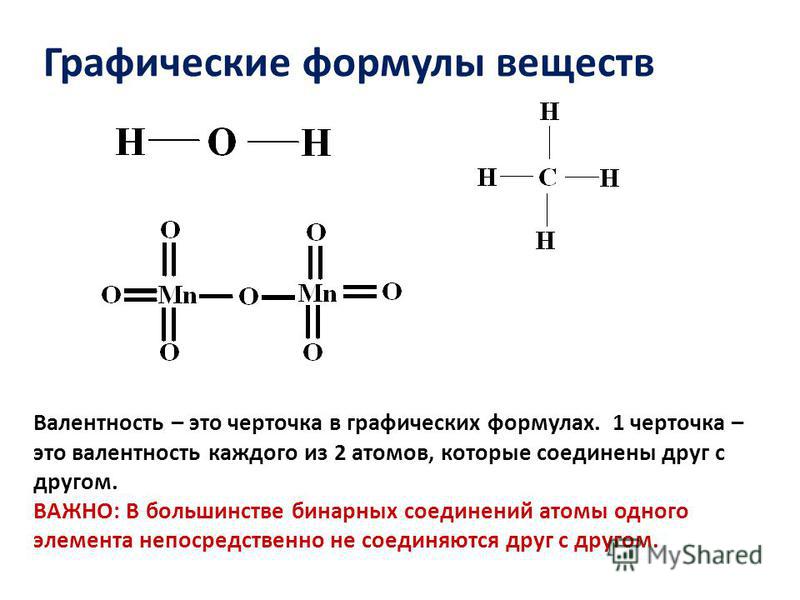 Но магнию нужно либо получить 6 электронов, либо потерять 2 электрона, чтобы выполнить свой октет.
Но магнию нужно либо получить 6 электронов, либо потерять 2 электрона, чтобы выполнить свой октет.
Поскольку легко потерять 2 электрона, Mg теряет 2 электрона на один атом азота. Когда азот получает 2 электрона от одного Mg и еще 1 электрон от другого Mg, его октет заполняется. Так в нитриде магния Mg3N2 октет обоих атомов подчиняется правилу октета.
Mg3N2 неподеленная пара электроновНеподелённую пару электронов, присутствующую в каждом атоме в молекуле, можно найти с помощью следующего уравнения.
Количество присутствующих неподеленных пар электронов = (валентные электроны атома — количество общих электронов) / 2
Неподеленная пара электронов в Mg =( 2 – 2)/2
= 0
Неподеленная пара электронов присутствует в N = (5-3)/2
= 1
Таким образом, неподеленные пары электронов, присутствующие в Mg, равны 0, а у азота 2 — 2.
Общее количество валентных электронов, существующих в Mg3N2 представляет собой сумму валентных электронов, присутствующих в 3 атомах Mg, и валентных электронов, присутствующих в 2 атомах N.
Общее количество валентных электронов в Mg3N2 = 3*2 + 5*2
= 6 + 10
= 16
Таким образом, все число валентных электронов, существующих в Mg3N2 это 16.
Mg3N2 ГибридизацияГибридизация это понятие, которое на самом деле мы применяем среди соединений с ковалентной связью. Так как мг3N2 является ионным соединением. Так что концепция гибридизации здесь не работает.
Mg3N2 ПользыПорошок нитрида магния используется для синтеза многих нитридных соединений, обладающих высокой износостойкостью, твердостью, теплопроводностью, антикоррозионными свойствами. Его устойчивость к высоким температурам делает его более полезным во многих областях. Он также используется для подготовки керамического материала и в качестве вспенивателя специального сплава.
Его устойчивость к высоким температурам делает его более полезным во многих областях. Он также используется для подготовки керамического материала и в качестве вспенивателя специального сплава.
Mg отдает свои 2 валентных электрона и становится Mg2+ . Азот принимает 3 электрона от двух Mg и становится N3-. Положительный магний2+ и отрицательный Н3- ионы притягиваются друг к другу, образуя ионную связь.
21.Общая характеристика s-элементов II группы. Магний, кальций.
s
-Элементы второй группы включают:
бериллий (Ве),
магний (Мg)
и щелочноземельные металлы – кальций
(Са),
стронций (Sr),
барий (Ва)
и радий (Rа).
Бериллий и магний существенно
отличаются от остальных элементов
данной группы. Бериллий является
амфотерным металлом. Магний образует
слабое основание, а щелочноземельные
металлы – сильные основания. Данные
металлы имеют на внешнем уровне по два
электрона и сравнительно легко их
отдают, превращаясь в двухзарядные
катионы. Они имеют большую, чем щелочные
металлы, твёрдость и довольно высокие
температуры плавления.Данные металлы
обладают высокой химической активностью.
Данные
металлы имеют на внешнем уровне по два
электрона и сравнительно легко их
отдают, превращаясь в двухзарядные
катионы. Они имеют большую, чем щелочные
металлы, твёрдость и довольно высокие
температуры плавления.Данные металлы
обладают высокой химической активностью.
МА́ГНИЙ — лёгкийковкий металл серебристо-белого цвета, горящий ярким белым пламенем.
Получают :
электролизом расплава
MgCl2 (электролиз) = Mg + Cl2.
Термический способ
MgO + C = Mg + CO
2Mg + O2 = 2MgO. Одновременно с оксидом образуется и нитрид магния Mg3N2: 3Mg + N2 = Mg3N2. C холодной водой реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие Mg + 2h3O = Mg(OH)2 + h3. 2Mg + CO2 = 2MgO + C. MgO + 2HNO3 = Mg(NO3)2 + h3O. 2NaOH + MgSO4 = Mg(OH)2 + Na2SO4. Mg + Br2 = MgBr2.
Mg + S = MgS. 3Mg + N2= Mg3N2. Mg3N2 + 6Н2О = 3Mg(ОН)2 + 2NН3.
КА́ЛЬЦИЙ — металл серебристо-белого цвета, входящий в состав известняков, мрамора и др.
Металлический кальций получают электролизом расплава
4CaO + 2Al = CaAl2O4 + 3Ca.
Ca + 2Н2О = Ca(ОН)2 + Н2. 2Са + О2= 2СаО; Са + Br2= CaBr2. кальций вступает вовзаимодействие при нагревании, Са + Н2= СаН2 (гидрид кальция), Ca + 6B = CaB6 (борид кальция), 3Ca + N2= Ca3N2 (нитрид кальция) Са + 2С = СаС2 (карбид кальция) 3Са + 2Р = Са3Р2 (фосфид кальция), известны также фосфиды кальция составов СаР и СаР5; 2Ca + Si = Ca2Si (силицид кальция), известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2. СаН2 + 2Н2О = Са(ОН)2 + 2Н2, Ca3N2 + 3Н2О = 3Са(ОН)2 + 2NН3. Оксид кальция — CaCO3 = CaO + CO2. CaО + Н2О = Ca(ОН)2. CaО +СО2 = СаСО3; СаО + SO3 = CaSO4. СаСО3 + СО2+ Н2О = Са(НСО3)2.
Все переходные элементы имеют следующие общие свойства:
Небольшие значения электроотрицательности.
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровненаходятся 2 валентных электрона, известна степень окисления +2.
Начиная с dэлементов III группы Периодической системы химических элементов Д. И. Менделеева,элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в
высшей — кислотные, в промежуточной — амфотерные.
Подгру́ппа ци́нка — химические элементы 12-й группы периодической таблицы химических элементов . В группу входят
Zn + 2HCl = ZnCl2 + h3 Zn + h3SO4 = ZnSO4 + h3
2Zn + O2 = 2ZnO
ZnO + C = Zn + CO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску,
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O.
С водой не взаимодействует.
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
2ZnO + SiO2 = Zn2SiO4,
ZnO + B2O3 = Zn(BO2)2.
2Zn + O2 = 2ZnO;
ZnCO3 = ZnO + CO2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество
Zn(OH)2 =
ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах :
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl.
23.d-элементы Iгруппы. Медь. Комплексные соединения меди.
Простые
вещества Cu, Ag, Au Медь, серебро и золото
мягкие блестящие металлы медь имеет
красноватую окраску,
золото желтую.Благодаря наличию одного
s-электрона во внешнем слое для этих
элементов характерна степень окисления
1. В
образовании химических связей могут
принимать участие также электроны с
d-оболочки, поэтому медь проявляет устойчивую
степень окисления 2, а золото 3. Химическая
активность металлов Сu,
Ag, Au сравнительно невелика.
Медь-Ме красного цвета, ковкий и мягкий; хороший проводник тепла и электричества.
Cu2O + h3SO4 = Cu + CuSO4 + h3O.
CuO + h3SO4 = CuSO4 + h3O
CuO + 2NaOH = Na2CuO2 + h3O Cu2O = CuO + Cu. CuO +СО = Cu + СО2. CuCl + НCl = H[CuCl2] h3S + CuSO4 = CuS + h3SO4 2Cu + 4HCl + O2 = 2CuCl2 + 2h3O. 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O. Cu + 2h3SO4 = CuSO4 + SO2+ 2h3O. 2FeCl3 + Cu = CuCl2 + 2FeCl2 Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2h3O.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4.
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4].
CuCl2 + 2NaCl = Na2[CuCl4].
2Cu + 8NH3 + 2H2O + O2 = 2[Cu(NH3)4](OH)2.
24.d-элементы VI группы. Хром, молибден.
Шестую побочную подгруппу (подгруппа хрома) образуют металлы: хром, молибден, вольфрам
Внешняя
электронная оболочка атомов элементов
содержит один или два электрона, что
обуславливает металлический характер
этих элементов .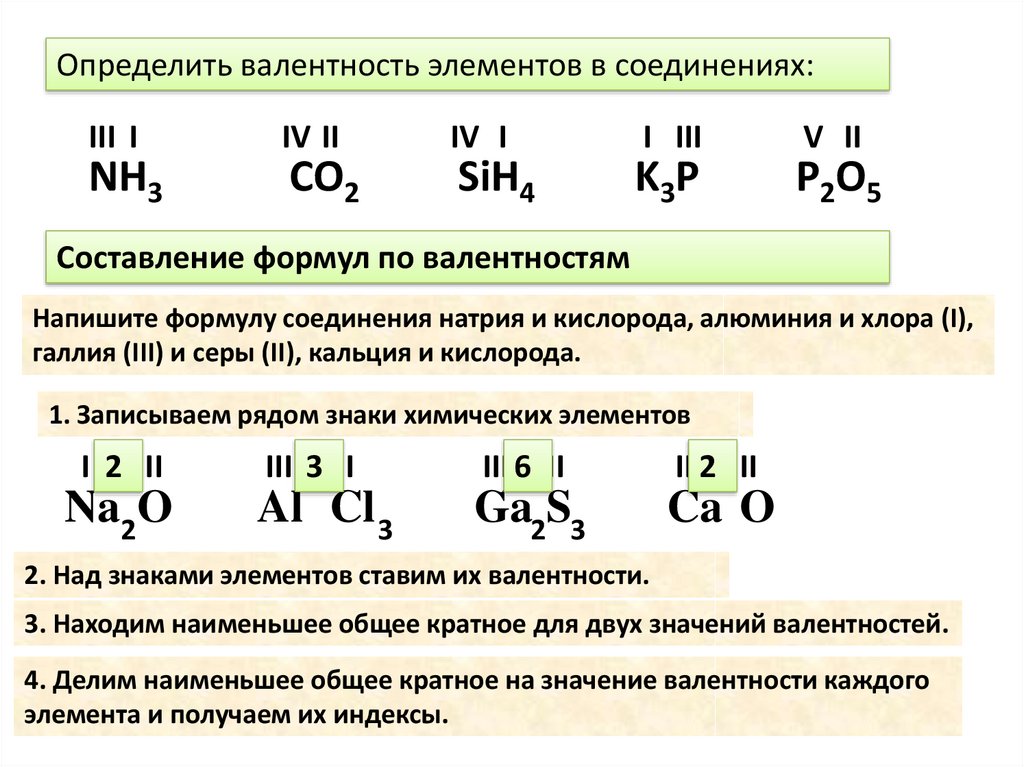 В ряду
Сr – Mo – W наблюдается повышение
температуры плавления.Максимальная
степень окисления у элементов подгруппы
хрома +6.
В ряду
Сr – Mo – W наблюдается повышение
температуры плавления.Максимальная
степень окисления у элементов подгруппы
хрома +6.
Хром В свободном виде — голубовато-белый металл .один из самых твердых металлов.
Устойчив на воздухе.
Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + Н2О.
K2Cr2O7 +
2KOH → 2K
h3CrnO3n+1 → H2О + nCrO3
2Na3 + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O.
Ba + CrO4 → BaCrO4↓.
K2Cr2O7 +
14HCl → 2CrCl3 +
2KCl + 3Cl2↑
+ 7H2O.
Молибден-твёрдый тугоплавкий металл с серебристо-белым блеском.
Промышленное получение молибдена: 2МоS2 + 7O2 = 2MoO3 + 4SO2
Mo + 2h3O = MoO2 + 2h3
MoO3 + 3h3 = Mo + 3h3O.
25.d-элементы VII группы. Марганец.
Подгру́ппа ма́рганца — химические элементы 7-й группы периодической таблицы химических элементов. В группу входят переходные металлы марганец Mn, технеций Tc и рений Re. имеют7 валентных электронов. Все они являются серебристо-белыми тугоплавкими металлами. В ряду Mn — Tc — Re химическая активность понижается.Марганец твердый хрупкий металл. Марганец образует несколько оксидов: MnO, Mn3O4, Mn2O3, MnO2 и Mn2O7.
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
MnCO3 = MnO + CO2
4MnO2 = 2Mn2O3 + O2
3MnO2 = Mn3O4 + O2
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Mn + 2HCl = MnCl2 + H2.
Mn(NO3)2 + 2NaOH = Mn(OH)2 + 2NaNO3
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
3K2MnO4 + 3Н2О = 2KMnO4 + MnO
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4
26.Элементы триады железа.
В триаду железа входят: железо (Fе), кобальт (Со) и никель (Ni) находятся в побочной подгруппе VIII группы. Это основные конструкционные металлы. Для железа наиболее характерны степени окисления +2, +3 и +6, а для кобальта и никеля – +2, +3
Получение железа
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II)
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO
+ CO
= Fe
+ CO2.
Железо – серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами.
В реакциях железо является восстановителем.
2Fe + 3Cl2 = 2FeCl3Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO Fe2O3)Оксид железа (II,III)
Fe + S = FeSСульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2Фосфид железа (II)
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
3Fe + 4H2O = Fe3O4 + 4H2
Железо реагирует с разбавленными серной и соляной кислотами
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При
обычной температуре железо не
взаимодействует с концентрированной
серной кислотой, так как пассивируется
ею.
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Fe + CuSO4 = FeSO4 + Cu, Fe0 + Cu2+ = Fe2+ + Cu0.
Соединения железа (II)
Оксид железа (II) FeO – черное кристаллическое вещество, нерастворимое в воде. получают :
Fe3O4 + CO = 3FeO + CO2.
FeO + 2HCl = FeCl2 + H2O
Гидроксид железа (II) Fe(OH)2 – порошок белого цвета, не растворяется в воде. Получают :
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4,
Fe(OH)2 + 2HCl = FeCl2 + 2H2O,
Fe(OH)2 = FeO + H2O.
Соединения железа (III)
Оксид
железа (III) Fe2O3 – порошок бурого цвета, не растворяется
в воде. получают:
получают:
А) разложением гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Б) окислением пирита (FeS2):
Оксид железа (III) проявляет амфотерные свойства:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Кобальт — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом
CoSO4 + h3S = CoS + h3SO4
Со3О4 + 4Н2 = 3Со + 4Н2О.
Никель- Серебристый металл
3Ni + 8HNO3 = 3Ni(NO3)2 + 2NO + 4h3O
Ni(NO3)2 + 2NaOH = Ni(OH)2 + 2NaNO3
2Ni(OH)2 + 2NaOH + Br2 = 2Ni(OH)3 + 2NaBr
Свойства нитрида магния(Mg3N2) (25 фактов, которые вы должны знать) Он состоит из трех атомов магния и двух атомов азота.
Давайте внимательно обсудим некоторые свойства (Mg 3 N 2 ). Нитрид магния можно получить обработкой магнием сухого азота или аммиака. Его кристаллическая структура может быть использована в качестве катализатора для синтеза боразона и светоизлучающих диодов. Нитрид магния обладает высокой коррозионной стойкостью. Это свойство нитрида магния делает его очень плодородным.
Его кристаллическая структура может быть использована в качестве катализатора для синтеза боразона и светоизлучающих диодов. Нитрид магния обладает высокой коррозионной стойкостью. Это свойство нитрида магния делает его очень плодородным.
В этой статье рассматриваются свойства нитрида магния, такие как его химическая классификация, магнитные свойства, температура плавления и кипения.
Нитрид магния Название IUPAC
Нитрид магния Название IUPAC — нитрид магния, также называемый динитрид тримагния.
Химическая формула нитрида магния
Химическая формула Mg 3 N 2 представляет собой нитрид магния. Атомный символ магния — М, а азота — N.
Нитрид магния Номер CAS
Регистрационный номер CAS нитрида магния — 12057-71-5 (это аутентичный числовой идентификатор, который может содержать до цифр).
Нитрид магния ChemSpider ID
Идентификатор ChemSpider ID нитрида магния: 10605770 .
Химическая классификация нитрида магния
- Нитрид магния является неорганическим соединением.
- Значение постоянной решетки пленок Mg 3 N 2 составляет около 0,996 нм.
- Повышение мощности распыления и температуры подложки может улучшить кристаллическое качество пленок Mg 3 N 2 .
- Нитрид магния похож на керамику.
- Нитрид магния обладает жаростойкостью и износостойкостью.
Молярная масса нитрида магния
Молярная масса нитрида магния 100,9494 г/моль.
Цвет нитрида магния
Нитрид магния зеленовато-желтого цвета .
Вязкость нитрида магния
Вязкость не применима к нитриду магния из-за его высокой температуры плавления.
Молярная плотность нитрида магния
Молярная плотность нитрида магния 0,0268моль/см 3 . Молярная плотность рассчитывается путем деления молярной массы на плотность. Таким образом, молярная плотность нитрида магния составляет 2,71/100,9.494=0,0268 моль/см 3 .
Молярная плотность рассчитывается путем деления молярной массы на плотность. Таким образом, молярная плотность нитрида магния составляет 2,71/100,9.494=0,0268 моль/см 3 .
Температура плавления нитрида магния
Нитрид магния имеет температуру плавления 1500 0 C. Эта повышенная температура плавления обусловлена кристаллической формой нитрида магния, поэтому между атомами существуют сильные силы притяжения.
Точка кипения нитрида магния
Точка кипения не работает для нитрида магния. Но может разлагаться при температуре 626°F.
Состояние нитрида магния при комнатной температуре
При комнатной температуре нитрид магния существует в виде белого кристаллического твердого вещества, поскольку его температура плавления выше комнатной температуры.
Ионно-ковалентная связь нитрида магния
Связь между магнием и азотом в нитриде магния является чисто ионной, поскольку ион магния отдает свои три электрона нитрид-иону, поэтому происходит образование связи.
Нитрид магния ионный радиус
Ионный радиус молекул — это не молекулы, но мы можем рассчитать ионные радиусы каждого атома отдельно. Ионные радиусы ионов магния и нитрида составляют 66 пм и 140 пм.
Электронные конфигурации нитрида магния
Согласно правилу Хунда, электронной конфигурацией является заполнение орбитальных электронов атома/молекулы в его электронной оболочке. Давайте посмотрим на электронную конфигурацию Mg 3 N 2 .
Электронная конфигурация азота и магния в нитриде магния: [Ne]3S 2 и 1S 2 2S 2 2P 3 . Каждый ион магния имеет два валентных электрона.
Степень окисления нитрида магния
В нитриде магния степень окисления каждого магния равна +2, поскольку он отдает два электрона внешней валентной оболочки азоту. Параллельно азот проявляет степень окисления -3, потому что он принимает 3 электрона от магния.
Нитрид магния кислотный/щелочной
Нитрид магния является кислым, потому что его p H находится между 5-7. Ионы нитрида притягивают электронное облако магния, что заставляет молекулу принимать электроны.
Нитрид магния не имеет запаха?
Нитрид магния представляет собой кристаллическое соединение без запаха.
Является ли нитрид магния парамагнитным?
Парамагнитный характер проявляют молекулы, имеющие неспаренные электроны на внешней валентной оболочке. Давайте посмотрим на магнитный характер нитрида магния.
Нитрид магния является непарамагнитным соединением, так как не содержит неспаренных электронов в своей валентной оболочке. Каждый ион магния отдает два своих неспаренных электрона нитрид-иону с дефицитом электронов, чтобы создать связь с нитрид-ионом.
Гидраты нитрида магния
Нитрид магния не обнаруживается в любой гидратной форме из-за его высокой температуры плавления .
Кристаллическая структура нитрида магния
Кристаллическая структура нитрида магния подобна корунду и кристаллизуется в кубической пространственной группе с параметрами кристаллической решетки a=b=c= 10,02 Å и α=β=ɣ= 90,00 0 .
Структура нитрида магнияПолярность и проводимость нитрида магния
- Нитрид магния представляет собой полярную молекулу, поскольку ионы магния отдают свои валентные электроны ионам нитрида, чтобы образовать с ним связь.
- Нитрид магния обладает высокой теплопроводностью с широкой запрещенной зоной около 2,8 эВ и является оптоэлектронным материалом в сине-фиолетовом диапазоне длин волн.
Реакция нитрида магния с кислотой
Нитрид магния реагирует с такими металлами, как HCl и H 2 SO 4 , с образованием хлоридов магния, сульфатов аммония и нитратов магния.
мг 3 N 2 + 8HCl → 3MGCL 2 + 2NH 4 CL
MG 3 N 2 + 4H 2 SO 4 3MO 40004 4 40004 4 40003 4. 40003 4. 40003 4. 40003 4. 40003 4. + H 8 N 2 O 4 S
40003 4. 40003 4. 40003 4. 40003 4. + H 8 N 2 O 4 S
3Mg 3 N 2 +28HNO 3 → 9 мг (№ 3 ) 2 +16NO+14H 2 O
Нитрид магния. Реакция нитрида с основанием
Магний. .
3CAO+MG 3 N 2 → 3MGO+CA 3 N 2
Реакция нитрида магния с оксидом
Нитрид -нитрид -бак с помощью акисида с магнитом и нитрий с магнитом и нитрий -асидий с магнитным асидиусом с магнитом и нитридом. .
мг 3 N 2 + 3NA 2 O → 3MGO + 2NA 3 N
MG 3 N 2 + 3K 2 O → 3MGO 2K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3K 3 + 3K 2 мг. N
N
Нитрид магния реагирует с металлом натрия с образованием нитрида натрия и магния
6NA+ MG 3 N 2 → 2NA 3 3 3 3 3 3 3 3 3 3 3 Н.
Заключение
Нитрид магния может быть использован для синтеза искусственных алмазов и для различных сплавов-вспенивателей. Катализируемые полимеры могут быть синтезированы с использованием этого нитрида магния.
Какова валентность a Фтор в CaF2 b Сера в SF6 c Фосфор в Ph4 d Углерод в Ch5 e Ni…
Перейти к
- Упражнение 1А
- Упражнение 1Б
- Упражнение 1С
- Глава 1.
 Язык химии
Язык химии - Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4. Атомная структура и химическая связь
- Глава 5 Периодическая таблица
- Глава 6 Изучение первого элемента водорода
- Глава 7 Изучение газовых законов
- Глава 8.
 Загрязнение атмосферы
Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 1 — Глава 1 Язык химии > Упражнение 1С > Вопрос 4
Вопрос 4 Упражнение 1С
Что такое валентность?
a) Фтор в CaF2
b) Сера в SF6
c) Фосфор в Ph4
d) Carbon in Ch5
e) Nitrogen in the following compound
i) N2O3 ii) N2O5 iii) NO2 iv) NO
f) Manganese in MnO2
g) Медь в Cu2O
з) Магний в Mg3N2
Ответ:
а) Валентность фтора в CaF2 равна -1.
b) Валентность серы в SF6 равна -6.
в) Валентность фосфора в Ph4 равна +3.
г) Валентность углерода в Ch5 равна +4.
e) Валентность азота в данных соединениях:
i) N2O3 = +3
ii) N2O5 = +5
iii)NO2 = +4
iv)NO = +2
Родственные вопросы
3 **Хлорид натрия реагирует с нитратом серебра с образованием хлорида серебра и нитрата натрия****a) Запись…
**Какую информацию передают следующие химические уравнения?****a) Zn+h3SO4— ZnSO4 + h3****b) …
**а) Что такое многоатомные ионы? Приведите два примера****б) Назовите основной закон, участвующий в каждом е…
**Почему уравнение должно быть сбалансировано? Объясните с помощью простого уравнения.**
**Напишите сбалансированные химические уравнения следующих словесных уравнений**
**Выберите правильный ответ из предложенных ниже вариантов****а) Современные атомарные символы основаны на.

 Язык химии
Язык химии Загрязнение атмосферы
Загрязнение атмосферы