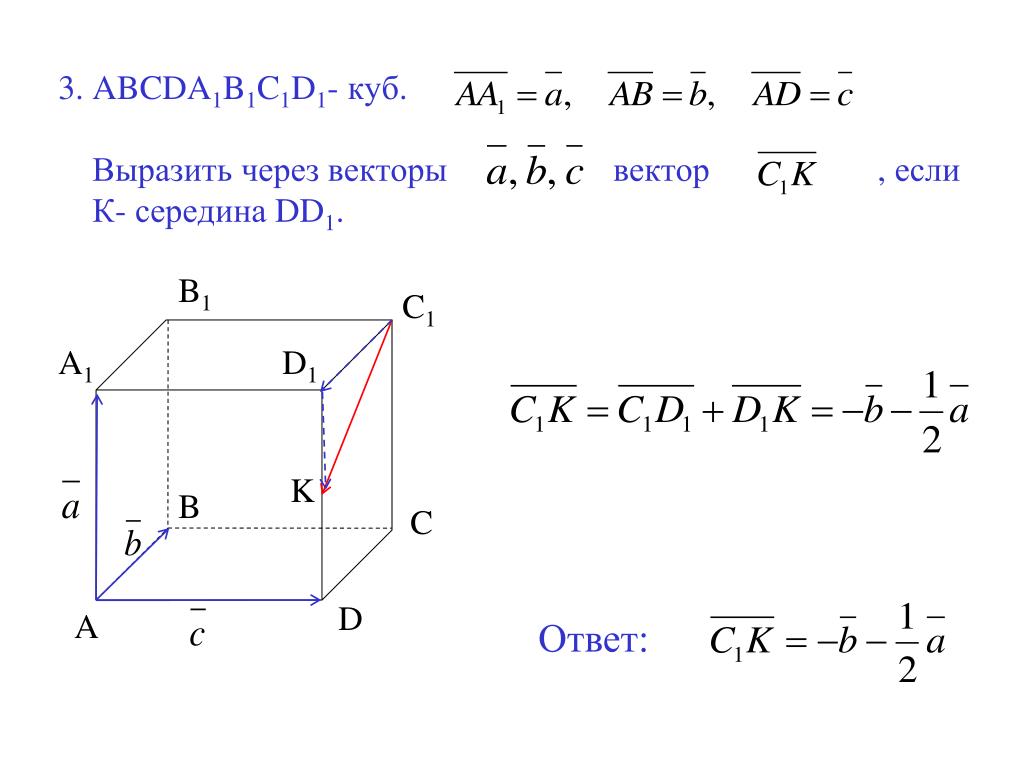
Сверхъемкие векторы yac, bac и pac
Рис. II.9. Схема клонирования сверхдлинных молекул ДНК с использованием вектора YAC
1 – линеаризация ДНК вектора рестриктазой BamHI;
2 – расщепление линеаризованной ДНК вектора рестриктазой EcoRI с образованием «плечей»; 3 – введение в вектор клонируемогоEcoRI-фрагмента ДНК
Хромосомы
высших организмов содержат в своем
составе протяженные молекулы ДНК.
Например, длина ДНК одной из типичных
хромосом человека составляет 100–200
миллионов пар оснований (м.п.о.).
Исследование генов в хромосомах высших
растений, животных и человека потребовало
создания векторов для клонирования
фрагментов ДНК длиной в несколько сотен
тысяч пар оснований. Этим задачам
отвечает недавно созданная система для
клонирования сверхдлинных молекул ДНК
на основе искусственно полученной
мини-хромосомы дрожжей YAC (yeast
artificial
chromosome).
Вектор
заключает в себе две теломерные
последовательности нуклеотидов TEL,
необходимые для репликации концов
мини-хромосомы, и область начала
репликации ARS1,
соединенную с последовательностью
центромеры. Все эти функциональные
элементы требуются для репликации
YAC-вектора и его правильной передачи в
дочерние ядра во время митоза. Кроме
того, вектор содержит два селектируемых
маркера TRP,
восстанавливающих способность к росту
ауксотрофных по триптофану клеток
дрожжей в отсутствие экзогенного
триптофана, а также маркер URA3,
компенсирующий генетический дефект
клеток дрожжей, который нарушает
биосинтез урацила. В векторе имеется
также ген супрессорной тРНК sup4,
являющийся селектируемым маркером для
поддержания вектора в мутантных
бактериальных клетках, содержащих
амбер-мутации в жизненно важных генах.
При
подготовке к клонированию YAC-вектор,
выделенный в виде плазмиды, расщепляют
рестриктазой BamHI
и отделяют от образовавшегося короткого
фрагмента ДНК, который не требуется для
репликации YAC-вектора в дрожжах (этап
1). После этого проводят второе расщепление
вектора рестриктазой EcoRI,
сопровождающееся образованием двух
его «плеч», каждое из которых на
одном из концов содержит теломерные
последовательности хромосомы дрожжей
(этап 2). На заключительном этапе (3)
полученные «плечи» лигируют с
крупными EcoRI-фрагментами
клонируемой ДНК, которые получают путем
частичного расщепления высокомолекулярной
хромосомной ДНК, предназначенной для
клонирования. Полученными таким образом
рекомбинантными ДНК трансформируют
протопласты клеток дрожжей, и образовавшиеся
трансформанты отбирают на селективной
твердой питательной среде. В таком
векторе удавалось осуществлять
клонирование фрагментов ДНК длиной до
700 т.
При всех своих достоинствах системы клонирования, основанные на векторах семейства YAC, обладают рядом существенных недостатков. В рекомбинантных ДНК, поддерживаемых в таких системах, часто возникают внутренние делеции. Кроме того, при введении рекомбинантных ДНК в клетки дрожжей иногда имеет место проникновение в одну клетку нескольких молекул вектора со вставками. В итоге отдельные клоны дрожжевых клеток могут содержать несколько несцепленных друг с другом молекул рекомбинантных ДНК, а рекомбинация между ними вообще может приводить к образованию химерных молекул. Все это очень затрудняет физическое картирование генов в хромосомах исследуемых объектов. Для преодоления такого рода трудностей были сконструированы альтернативные векторные системы, среди которых наиболее популярными в настоящее время являются системы, основанные на искусственных хромосомах бактерий – BAC(bacterialartificialchromosome).
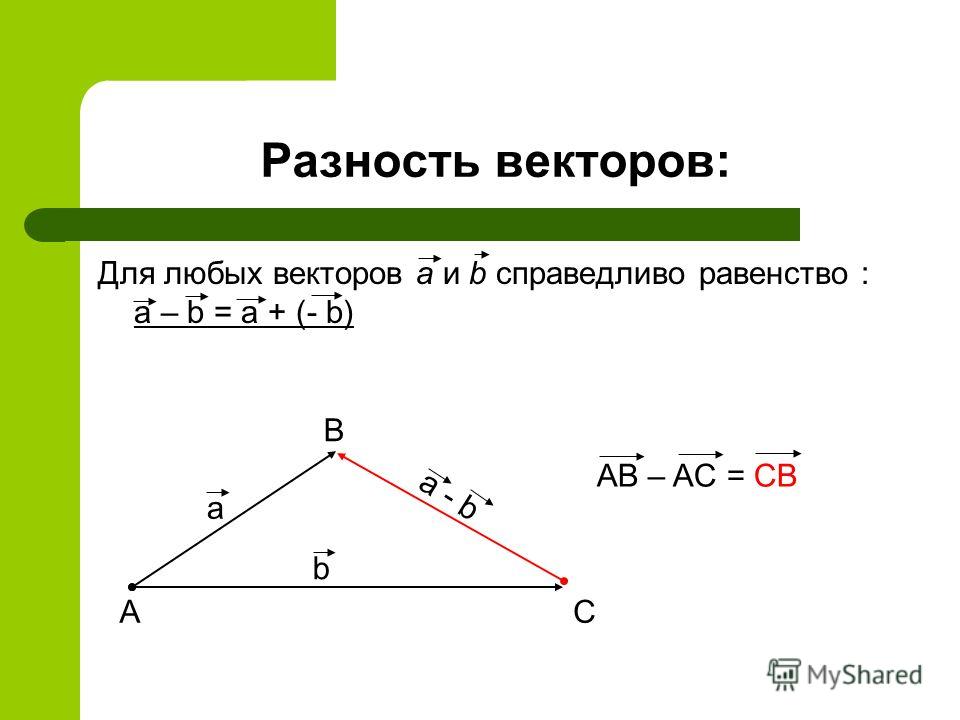
Рис. II.10. Вектор pBAC108L – представитель семейства BAC-векторов
В векторных системах BAC используется
ДНК хорошо изученного полового фактора(F-фактора) E. coli – гигантской
плазмиды мужских бактериальных клеток,
которые являются донорами бактериальной
ДНК при конъюгации с женскими клетками
(рис. II.10). Типичный F-фактор содержит
геныoriS, repE, parAиparB, регулирующие
его собственную репликацию и контролирующие
число его копий в бактериальных клетках.
В частности, геныoriS
coli – гигантской
плазмиды мужских бактериальных клеток,
которые являются донорами бактериальной
ДНК при конъюгации с женскими клетками
(рис. II.10). Типичный F-фактор содержит
геныoriS, repE, parAиparB, регулирующие
его собственную репликацию и контролирующие
число его копий в бактериальных клетках.
В частности, геныoriS
 6.2), а также прямого секвенирования
клонированной ДНК в месте стыковки с
вектором. Кроме того, во фрагменте
имеется сайтcosN, обеспечивающий
расщепление вектора со вставкой в
уникальном месте с помощьютерминазы фагабез применения
ферментов рестрикции. Этот фермент
используется бактериофагом для
специфического разрезания конкатемеров
своей хромосомы при упаковке в фаговые
частицы. Для той же цели может быть
применен и сайтloxPбактериофага Р1,
который является мишенью для фаговой
эндонуклеазы Cre. Эти сайты используются
для получения специфических концов
клонированной ДНК с целью ее дальнейшего
рестрикционного картирования путем
введения концевой метки с последующим
неполным расщеплением с помощью
рестриктаз и электрофоретическим
разделением образовавшихся фрагментов
(см. раздел 7.6.1).
6.2), а также прямого секвенирования
клонированной ДНК в месте стыковки с
вектором. Кроме того, во фрагменте
имеется сайтcosN, обеспечивающий
расщепление вектора со вставкой в
уникальном месте с помощьютерминазы фагабез применения
ферментов рестрикции. Этот фермент
используется бактериофагом для
специфического разрезания конкатемеров
своей хромосомы при упаковке в фаговые
частицы. Для той же цели может быть
применен и сайтloxPбактериофага Р1,
который является мишенью для фаговой
эндонуклеазы Cre. Эти сайты используются
для получения специфических концов
клонированной ДНК с целью ее дальнейшего
рестрикционного картирования путем
введения концевой метки с последующим
неполным расщеплением с помощью
рестриктаз и электрофоретическим
разделением образовавшихся фрагментов
(см. раздел 7.6.1). Современные BAC-векторы позволяют
клонировать фрагменты ДНК длиной до
300 т.п.о. и выше. Рекомбинантные молекулы
вводятся в клетки E. coli с помощью
электропорации (см. раздел 7. 3.2), причем
эффективность образования трансформантов
в 10–100 раз выше, чем при обычной
трансформации сферопластов дрожжей
векторами семейства YAC. Это позволяет
уменьшить исходное количество ДНК,
необходимое для конструирования
репрезентативных клонотек генов (см.
раздел 7.3). При скрининге таких клонотек
используются традиционные методы работы
с бактериальными колониями (раздел
7.3.3). В отличие от YAC-ДНК, которая находится
в клетках дрожжей в линейной форме,
BAC-векторы со вставками, как и традиционные
F’-факторы, существуют в бактериальных
клетках в виде кольцевых суперскрученных
молекул. Это облегчает их выделение и
последующую работу с рекомбинантными
молекулами ДНК в растворе, а кроме того,
допускает простое повторное введение
в бактериальные клетки этих ДНК,
выделенных минипрепаративными методами.
Поскольку рекомбинантные BAC-векторы
существуют в бактериальных клетках в
виде одной копии, исключаются совместное
клонирование в одной клетке разных
фрагментов ДНК и образование химерных
молекул, что весьма существенно для
физического картирования больших
геномов методами «снизу вверх»
(см.
3.2), причем
эффективность образования трансформантов
в 10–100 раз выше, чем при обычной
трансформации сферопластов дрожжей
векторами семейства YAC. Это позволяет
уменьшить исходное количество ДНК,
необходимое для конструирования
репрезентативных клонотек генов (см.
раздел 7.3). При скрининге таких клонотек
используются традиционные методы работы
с бактериальными колониями (раздел
7.3.3). В отличие от YAC-ДНК, которая находится
в клетках дрожжей в линейной форме,
BAC-векторы со вставками, как и традиционные
F’-факторы, существуют в бактериальных
клетках в виде кольцевых суперскрученных
молекул. Это облегчает их выделение и
последующую работу с рекомбинантными
молекулами ДНК в растворе, а кроме того,
допускает простое повторное введение
в бактериальные клетки этих ДНК,
выделенных минипрепаративными методами.
Поскольку рекомбинантные BAC-векторы
существуют в бактериальных клетках в
виде одной копии, исключаются совместное
клонирование в одной клетке разных
фрагментов ДНК и образование химерных
молекул, что весьма существенно для
физического картирования больших
геномов методами «снизу вверх»
(см.
В заключение следует упомянуть о семействе векторов PAC (P1-derived artificialchromosome), также часто используемых в современных исследованиях. Векторы этой серии содержат гены бактериофага Р1, обеспечивающие репликацию фаговой хромосомы в зараженных бактериальных клетках. Рекомбинантные ДНК на их основе (размер вставки 150–200 т.п.о.) также вводятся в бактериальные клетки с помощью электропорации.
big bac вектор бесплатно | AI, SVG и EPS
- Все
- AI
- CDR
- EPS
- SVG
- Все
- Белый
- Красный
- Оранжевый
- Жёлтый
- Зелёный
- Вода
- Синий
- Фиолетовый
- Розовый
- Чёрный
- Серый
Животных водой большие большие млекопитающие океана китов
Большой экономии картинки
Животные Architetto Фран крупных млекопитающих кошки Леоне млекопитающих кошачьих
Биг Бен, дома парламента
Большой гриб картинки
Swamp seamless pattern.
 Big green morass texture. Bubbles on bac
Big green morass texture. Bubbles on bacОблако Server компьютер большой веб электронной почты ЭВМ Intel многопользовательской Vintage Amd
Серый Африка наброски профиль силуэт ноги Silhouet мультфильм большой слон Olifant труба Индия африканских индийских нос животного Elefant Олифант слон хвост Afrika уши джунглях африканцев цирк Jumbo силуэт Ele
Bokeh background
большой грузовик картинки
Большая рыба картинки
Multi-colored Easter eggs hidden in green grass big seamless bac
Биг-Бен размер картинки
NixVex Big Bang 03 свободный вектор
Big Rig грузовиков
Intel MMX big logo
Большой нефти Роб
Здания здание дом дом большой дома
биг-бен
Большой кирпич картинки
Canis Major Constellation with Beautiful Bright Stars on the Bac
Vector illustration of the indian elephant isolated on white bac
большой красный лук
unPicassed большой герой
Животные наметить контур крупных млекопитающих животных млекопитающих кошки Cheetah кошачьих
Дорога с много большой совет баннер
11bac [P-eveden]
Большой мешок денег картинки
Большой Earred клоун картинки
Окраска книга Ozark большой ушастый битой картинки
Big black abstact long brush strokes set isolated on a white bac
Business support, big hand helping businessman to cross big gap obstacle
Большая рыба Candat животных картинки
Война бой большая битва оружия пуля оружия убивают стрелять ружье
Big pink curtain draped with lambrequins isolated on a white bac
Свободный вектор большая Рождественская елка
Kleenex oval logo big logo in vector format .
 ai (illustrator) and .eps for free download
ai (illustrator) and .eps for free downloadБольшой грузовик контейнер транспортного перемещения
Motudo экране мобильного телефона с большой картинки
Сервера большая башня Картинки
зеленая лягушка с большими глазами вектор
Swamp seamless pattern.
 Big green morass texture. Bubbles on bac
Big green morass texture. Bubbles on bacVector drawing of forklift.
Vector Illustration of a seamless Xmas background. Christmas, new year, birthday party theme in Vintage colors, beige, pale blue and dull orange brown party and celebration elements like swirls, wrapped up gift boxes, confetti and one star on a white bac
Технология бактериальных искусственных хромосом (ВАС)
Онлайн-запрос
Бактериальные искусственные хромосомы (ВАХ) представляют собой большие стабильно поддерживаемые геномные клоны, способные размножать большие и нестабильные фрагменты чужеродной ДНК в Escherichia coli . В последние годы технология BAC также была адаптирована для манипуляций с вирусными геномами и стала эффективной альтернативой традиционной генной инженерии рекомбинантных онколитических вирусов, особенно крупных ДНК-вирусов, таких как герпес, вирус коровьей оспы и бакуловирусы. Кроме того, эта инновационная технология также позволяет быстро и удобно генерировать частицы рекомбинантных аденовирусов. BAC также позволяет бесследно вводить любую мутацию с использованием современных инструментов бактериальной генетики.
В последние годы технология BAC также была адаптирована для манипуляций с вирусными геномами и стала эффективной альтернативой традиционной генной инженерии рекомбинантных онколитических вирусов, особенно крупных ДНК-вирусов, таких как герпес, вирус коровьей оспы и бакуловирусы. Кроме того, эта инновационная технология также позволяет быстро и удобно генерировать частицы рекомбинантных аденовирусов. BAC также позволяет бесследно вводить любую мутацию с использованием современных инструментов бактериальной генетики.
Преимущества технологии ВАС
BAC был многообещающим инструментом, который должен значительно облегчить нашу способность манипулировать экспрессией генов при конструировании онколитического вируса. Он показал много преимуществ по сравнению с традиционными векторами клонирования.
- BAC могут принимать трансгены длиной до 300 т.п.н., что достаточно для поддержания геномов онколитических вирусов. Более того, большой размер BAC помогает свести к минимуму эффекты интеграции.

- Эндогенная экспрессия генов более точна, чем в других системах клонирования.
- BAC поддерживает стабильность и высокую точность распространения вставок в течение нескольких поколений.
- Клоны ВАС позволяют оценить не только геномную вариацию, существующую в изоляте вируса, но и то, как эти различия влияют на биологию вируса.
- Клон BAC помогает улучшить эффекты in vitro пассаж изолятов вируса.
- ВАС можно трансфецировать и экспрессировать во многих клеточных линиях млекопитающих, даже если эффективность трансфекции и количество копий низкие.
Технология BAC в конструировании онколитических вирусов
Технология ВАС применялась для быстрого и удобного конструирования рекомбинантных вирусов. Здесь мы описываем использование клонирования BAC для осуществления генетических манипуляций и создания рекомбинантных вирусов HSV, экспрессирующих трансген. Вообще говоря, конструирование HSV-BAC включает прямую вставку вектора BAC в определенный сайт вирусного генома посредством гомологичной рекомбинации или с использованием перекрывающихся космид, покрывающих весь геном HSV, для рекомбинации в эукариотической клетке. Среди них чаще используется первый метод. Для этого процесса ВАС-вектор с фланкированными геномными последовательностями ВПГ линеаризуют с использованием рестрикционных ферментов и совместно трансфицируют очищенной вирусной геномной ДНК в пермиссивные вирусные клетки.
Среди них чаще используется первый метод. Для этого процесса ВАС-вектор с фланкированными геномными последовательностями ВПГ линеаризуют с использованием рестрикционных ферментов и совместно трансфицируют очищенной вирусной геномной ДНК в пермиссивные вирусные клетки.
- Шаг 1: конструируется вектор ВАС, содержащий необходимые бактериальные гены для репликации и поддержания, а также гомологичные фланкирующие последовательности (отмечены красным).
- Шаг 2: Эукариотические клетки инфицируют ВПГ, и кольцевой вирусный геном извлекается с помощью экстракции Hirt.
- Этап 3: вектор BAC линеаризуют, котрансфицируют вирусную ДНК в эукариоты и извлекают последовательности HSV-BAC.
- Шаг 4: ДНК HSV-BAC трансформируют в E. coli . Мутагенез осуществляется при сохранении вирусного ВАС в бактериях. Экстрагируют рекомбинантную вирусную ДНК BAC.
- Шаг 5: Вирусная ДНК BAC трансфицируется в эукариоты, и рекомбинантные вирусы спасаются для получения инфекционного вируса.

Рис.1. Конструирование вирусных бактериальных искусственных хромосом (ВАХ). (Нигардас, 2013 г.)
Применение векторов BAC
Технология BAC широко использовалась для быстрой замены трансгенов или создания специфических мутаций более легко, чем классическая гомологичная рекомбинация во время конструирования онколитического вируса. В Creative Biolabs , мы регулярно используем эту технологию для создания ряда различных рекомбинантных вирусов, несущих либо терапевтические, либо репортерные гены. BAC особенно полезны для изучения крупных вирусов, потому что ДНК этих вирусов слишком велики, чтобы их можно было клонировать в отдельные плазмиды. Помимо BAC, мы также предлагаем другие решения для конструирования и разработки онколитических вирусов.
Ссылки
- Нюгардас, М. Патогенез вируса простого герпеса типа 1 (ВПГ-1) и генная терапия ВПГ экспериментального аутоиммунного энцефаломиелита. 2013.

Пожалуйста, не стесняйтесь обращаться к нам для получения предложения и дальнейшего обсуждения с нашими учеными.
Все продукты и услуги предназначены только для исследовательских целей. Не для клинического использования.
- Имя
- * Телефон
- * Электронная почта
- * Заинтересованные продукты или услуги:
- Описание Проекта
Модернизация клонирующего вектора ВАС pBeloBAC11 путем вставки мутантного сайта loxP | BMC Research Notes
Модернизация клонирующего вектора BAC pBeloBAC11 путем вставки мутантного сайта loxP
Скачать PDF
Скачать PDF
- Исследовательская записка
- Открытый доступ
- Опубликовано:
- Джонатон С. Корен 1
Исследовательские заметки BMC том 10 , Номер статьи: 344 (2017) Процитировать эту статью
1522 доступа
2 Цитаты
2 Альтметрика
Сведения о показателях
Abstract
Objective
Геномные библиотеки человека, сконструированные в бактериальных векторах искусственных хромосом, использовались для создания физических карт всех 23-хромосомных пар и в качестве шаблонов для секвенирования ДНК, чтобы помочь в завершении проекта «Геном человека». Цель этого исследования состояла в том, чтобы модифицировать ВАС-вектор pBeloBAC11 таким образом, чтобы геномные вставки, содержащиеся в этом векторе, могли подвергаться двунаправленным транспозон-опосредованным вложенным делециям из дикого типа и мутанта 9.0086 loxP Присутствует сайтов.
Цель этого исследования состояла в том, чтобы модифицировать ВАС-вектор pBeloBAC11 таким образом, чтобы геномные вставки, содержащиеся в этом векторе, могли подвергаться двунаправленным транспозон-опосредованным вложенным делециям из дикого типа и мутанта 9.0086 loxP Присутствует сайтов.
Результаты
Олигонуклеотид, содержащий мутантный сайт loxP 2272 и последовательность фермента рестрикции Xho I, был сконструирован и вставлен в сайт рестрикции Sfi I, расположенный приблизительно на 200 пар оснований выше гена placZ 1BeloBAC 9008. Клоны, содержащие желаемую вставку, идентифицировали с помощью рестрикционных гидролизатов Xho I, поскольку была получена дополнительная полоса. Эта технология делеции, опосредованная транспозонами, позволяет исследователям идентифицировать границы цис -действующие элементы и гены.
Введение
Векторы бактериальной искусственной хромосомы (BAC) и искусственной хромосомы P1 (PAC) использовались для создания геномных библиотек человека для проекта Human Genome Project (HGP), поскольку они могли вмещать вставки размером до 300 килобаз (т. п.н.) и не генерировали химерные клоны [1, 2]. Поскольку векторы PAC были получены из плазмиды pAd10sacBII, все они содержали сайт loxP , который является частью генома бактериофага P1 [3, 4].
п.н.) и не генерировали химерные клоны [1, 2]. Поскольку векторы PAC были получены из плазмиды pAd10sacBII, все они содержали сайт loxP , который является частью генома бактериофага P1 [3, 4].
Плазмида транспозона mini-Tn10, содержащая сайт loxP , была разработана для модификации клонов P1 для создания вложенных делеций [5]. Затем мы использовали эту технологию, чтобы продемонстрировать, что большие вложенные делеции могут быть получены как в клонах PAC, так и в BAC [6]. В исследовании Lee и Saito [7] изучалась роль, которую каждый нуклеотид в этой последовательности из 34 п.н. играет в процессе рекомбинации. Они идентифицировали две замены двойных оснований в 8-п.о. спейсерной области (5171 и 2272), которые эффективно рекомбинировали с идентичным мутантом, но не с другим мутантом или диким типом 9.0086 loxP сайт.
Целью данного исследования была модификация клонирующего вектора BAC pBeloBac11, чтобы сделать его более универсальным для различных исследований. Олигонуклеотиды, содержащие версию 2272 мутантного сайта loxP и внутреннюю рестрикционную последовательность Xho I, конструировали и лигировали в сайт Sfi I этого ВАС-вектора. Исследователи могут трансформировать транспозонные плазмиды, несущие либо дикий, либо мутантный сайт loxP , в сайт E. coli 9.0087, содержащие любой представляющий интерес клон ВАС, созданный в pBeloBac11 для создания транспозон-опосредованных вложенных делеций с обоих концов геномной ДНК.
Олигонуклеотиды, содержащие версию 2272 мутантного сайта loxP и внутреннюю рестрикционную последовательность Xho I, конструировали и лигировали в сайт Sfi I этого ВАС-вектора. Исследователи могут трансформировать транспозонные плазмиды, несущие либо дикий, либо мутантный сайт loxP , в сайт E. coli 9.0087, содержащие любой представляющий интерес клон ВАС, созданный в pBeloBac11 для создания транспозон-опосредованных вложенных делеций с обоих концов геномной ДНК.
Основной текст
Методы
Были синтезированы и очищены в геле (Sigma-Genosis) следующие олигонуклеотиды: 5’CTCGAGATAACTTCGTATAAAGTATCCTATACGAAGTTATCCC3′ и 5’ATAAACTTCGTATAGGATACTTTATACGAAGTTATCTCGAGGGG3′. Каждый олигонуклеотид растворяли в 10 мМ Трис-Cl, 1 мМ ЭДТА, pH 8,0 (TE) в конечной концентрации 1 мкг/мл и инкубировали при 4 °C в течение ночи. Олигонуклеотиды объединяли в присутствии 50 мМ NaCl и нагревали до 80 °C в течение 5 мин, а затем медленно охлаждали до комнатной температуры.
500-кратный молярный избыток двухцепочечного олигонуклеотида инкубировали с ДНК pBeloBac11, расщепленной с помощью Sfi I, в течение 2 ч при 37 °C (New England BioLabs) в присутствии 1 ЕД ДНК-лигазы T4. (Invitrogen) при 15°C в течение ночи. Реакцию лигирования инактивировали нагреванием при 70 °C в течение 15 минут, а затем подвергали точечному диализу против 0,5X TE в течение 1 часа. Аликвоты по две мкл реакции лигирования смешивали с 25 мкл электрокомпетентных клеток Dh20B (Invitrogen), помещали в кювету с зазором 1 см (BTX) и подвергали электропорации при 2,5 кВ и 129°С.Ом с использованием BTX Electro Cell Manipulator 600. Клеткам давали восстановиться в 1 мл среды SOC (Invitrogen) при 37 °C и 225 об/мин в течение 1 часа, а затем аликвоты по 100 мкл распределяли на LB + 34 мкг/мл CM (Sigma ) тарелки. Отдельные колонии выращивали в течение ночи в 2,5 мл среды LB + CM, а ДНК получали с использованием процедуры минипрепарата щелочного лизиса [8]. Образцы ДНК расщепляли 10 ЕД Xho I в течение 2 часов при 37 °C (New England BioLabs) и подвергали электрофорезу в 0,8% агарозном геле в 0,5X TBE.
Результаты
Поскольку клонирующий вектор ВАС pBeloBAc11 был коммерчески доступен в New England BioLabs, я решил модифицировать эту плазмиду, чтобы повысить ее пригодность для геномных исследований. Были сконструированы и синтезированы два комплементарных олигонуклеотида, содержащих вариант 2272 мутантного сайта loxP . Я также включил сайт рестрикции Xho I на 5′-конце олигонуклеотида CTCGAGATAACTTCGTATAAAGTATCCTATACGAAGTTATCCC и на 3′-конце комплементарного олигонуклеотида, чтобы можно было идентифицировать успешную вставку мутанта 9.0086 loxP в pBeloBac11, который содержит один сайт Xho I (рис. 1). Затем олигонуклеотиды объединяли, нагревали до 80 °C и медленно охлаждали до комнатной температуры, чтобы произошел отжиг.
Рис. 1 Дизайн мутантного олигонуклеотида loxP . Инвертированные повторы длиной 13 пар оснований: , подчеркнуто . Мутированные основания в центральном спейсере размером 8 п. н. показаны заштрихованным серым шрифтом . Также указан сайт Xho I
н. показаны заштрихованным серым шрифтом . Также указан сайт Xho I
Изображение полного размера
500-кратный молярный избыток двухцепочечного олигонуклеотида лигировали с Sfi I-расщепленным pBeloBac11, лигирование подвергали электропорации в клетки Dh20B и наносили на чашки LB + хлорамфеникол (CM). Я получил минипрепарат ДНК из нескольких трансформантов, расщепил их с помощью Xho I и проанализировал клоны с помощью электрофореза в агарозном геле. Желаемый клон будет генерировать две полосы размером 5,8 и 1,7 т.п.н., в то время как повторно лигированный вектор будет генерировать одну полосу размером 7,5 т.п.о. Я идентифицировал несколько клонов с нужным мутантом loxP сайт; показан один из этих трансформантов (рис. 2, дорожка 4). Этот недавно созданный вектор pBeloBac11-loxP* проиллюстрирован (рис. 3).
Рис. 2 Xho I переваривает минипрепарат ДНК. Каждый образец ДНК расщепляли Xho I и подвергали электрофорезу на 0,8% агарозном геле. Дорожки 1–7 представляют различные трансформанты. Дорожка 8 представляет собой лестницу размером 1 КБ
Каждый образец ДНК расщепляли Xho I и подвергали электрофорезу на 0,8% агарозном геле. Дорожки 1–7 представляют различные трансформанты. Дорожка 8 представляет собой лестницу размером 1 КБ
Полноразмерное изображение
Рис. 3Вектор pBeloBac11-loxP*. Мутантный сайт 2272 loxP был вставлен перед геном lacZ
Полноразмерное изображение
Обсуждение
Xho I расщепления трансформантов, полученных в результате лигирования мутантного олигонуклеотида loxP с pBeloBac11, показали, что был получен модифицированный вектор. Вложенные делеции, происходящие из мутантного сайта l oxP клонов BAC из пилотной геномной библиотеки, созданной в этом исследовании, могут быть созданы с использованием системы мини-транспозонов, которую мы использовали ранее (рис. 3) [6]. Во-первых, вектор мини-транспозона, содержащий мутант 9Сайт 0086 loxP должен быть трансформирован в представляющий интерес клон ВАС. При добавлении IPTG кассета транспозона mini-Tn10 случайным образом интегрируется в клон BAC. При заражении этих клеток литическим штаммом бактериофага Р1 между двумя мутантными сайтами loxP будут возникать делеции, пока они находятся в одной ориентации (рис. 4) [5]. В качестве альтернативы, существующие клоны BAC можно расщепить с помощью Not I для высвобождения геномной ДНК. Затем нужный фрагмент можно лигировать на Не I-расщепленный pBeloBac11-loxP * . Делеции, исходящие из сайта дикого типа l oxP , могут быть получены с использованием транспозонной плазмиды pTnPGKpuro/loxP-EBV; это также модифицирует клон ВАС, чтобы он также мог размножаться в клетках млекопитающих, поскольку он будет содержать латентный источник репликации вируса Эпштейна-Барра (EBV) или oriP и трансактивирующий ген EBNA-1 [9]. Использование этой технологии позволит исследователям идентифицировать обе границы цис -действующие элементы и гены.
При добавлении IPTG кассета транспозона mini-Tn10 случайным образом интегрируется в клон BAC. При заражении этих клеток литическим штаммом бактериофага Р1 между двумя мутантными сайтами loxP будут возникать делеции, пока они находятся в одной ориентации (рис. 4) [5]. В качестве альтернативы, существующие клоны BAC можно расщепить с помощью Not I для высвобождения геномной ДНК. Затем нужный фрагмент можно лигировать на Не I-расщепленный pBeloBac11-loxP * . Делеции, исходящие из сайта дикого типа l oxP , могут быть получены с использованием транспозонной плазмиды pTnPGKpuro/loxP-EBV; это также модифицирует клон ВАС, чтобы он также мог размножаться в клетках млекопитающих, поскольку он будет содержать латентный источник репликации вируса Эпштейна-Барра (EBV) или oriP и трансактивирующий ген EBNA-1 [9]. Использование этой технологии позволит исследователям идентифицировать обе границы цис -действующие элементы и гены.
 4
4 Схема восстановления делеций BAC. Плазмиду транспозона вводят в клетку, содержащую интересующий клон ВАС. Случайная транспозиция кассеты mini Tn10 в клон ВАС инициируется добавлением IPTG. P1 вир Инфекция s приводит к делеции ДНК между двумя мутантными сайтами loxP в одинаковой ориентации и образованию коинтеграта P1-ВАС. Упаковка P1 начинается в pac , пока капсид не заполнится. Заражение штамма Cre + NS3516 приводит к циклизации клона ВАС M. Клонирование и стабильное поддержание фрагментов ДНК человека размером 300 пар оснований в Escherichia coli с использованием вектора на основе F-фактора. Proc Natl Acad Sci USA. 1992; 89: 8794–7.
Артикул КАС пабмед ПабМед Центральный Google Scholar
Иоанну П.А., Амемия К.Т., Гарнес Дж., Кройзель П.М., Сидзуя Х., Чен С., Батцер М.А. , де Йонг П.Дж. Новый вектор, полученный из бактериофага P1, для размножения больших фрагментов ДНК человека. Нат Жене. 1994; 6: 84–9.
, де Йонг П.Дж. Новый вектор, полученный из бактериофага P1, для размножения больших фрагментов ДНК человека. Нат Жене. 1994; 6: 84–9.
Артикул КАС пабмед Google Scholar
Pierce JC, Sauer B, Sternberg N. Вектор положительной селекции для клонирования высокомолекулярной ДНК с помощью системы бактериофага P1: повышенная эффективность клонирования. Proc Natl Acad Sci USA. 1992;89:2056–60.
Артикул КАС пабмед ПабМед Центральный Google Scholar
Сидзуя Х., Курос-Мехр Х. Разработка и применение бактериальной искусственной хромосомной системы. J Мед. 2001; 50: 26–30.
КАС Google Scholar
Чаттерджи П.К., Штернберг Н. Модернизация высокомолекулярных ДНК, клонированных в P1: введение репортерных генов, маркеров, селектируемых в клетках млекопитающих, и создание вложенных делеций. Жене Анал. 1996;13:33–42.
Жене Анал. 1996;13:33–42.
Артикул КАС пабмед Google Scholar
Чаттерджи П.К., Корен Дж.С. Выделение больших вложенных делеций в бактериальных и искусственных хромосомах P1 путем упаковки P1 in vivo продуктов Cre-катализируемой рекомбинации между эндогенным и транспонированным сайтом loxP . Нуклеиновые Кислоты Res. 1997; 25:2205–12.
Артикул КАС пабмед ПабМед Центральный Google Scholar
Lee G, Saito I. Роль нуклеотидных последовательностей спейсерной области loxP в Cre-опосредованной рекомбинации. Ген. 1988; 216: 55–65.
Артикул Google Scholar
Birnboim HC, Doly J. Процедура быстрой щелочной экстракции для скрининга рекомбинантной плазмидной ДНК. Нуклеиновые Кислоты Res. 1979; 7: 1513–23.
Артикул КАС пабмед ПабМед Центральный Google Scholar
Корен Дж. С., Штернберг Н. Конструирование векторной системы PAC для размножения геномной ДНК в клетках бактерий и млекопитающих и последующего создания вложенных делеций в отдельных членах библиотеки. Ген. 2001; 264:11–8.
Артикул КАС пабмед Google Scholar
Ссылки на скачивание
Благодарности
Неприменимо.
Конкурирующие интересы
Автор заявляет, что у него нет конкурирующих интересов.
Доступность данных и материалов
pBeloBac11-loxP* доступен в Addgene (ID# 60342).
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Информация об авторе
Авторы и организации
Факультет биологии, Элизабеттаунский колледж, One Alpha Drive, Элизабеттаун, Пенсильвания, 17022, США
Джонатон С. Корен
Авторы
- Джонатон С.


 Big green morass texture. Bubbles on bac
Big green morass texture. Bubbles on bac ai (illustrator) and .eps for free download
ai (illustrator) and .eps for free download Big green morass texture. Bubbles on bac
Big green morass texture. Bubbles on bac