Zn(NO3)2·4h3O (Zn[NO3]2[h3O]4) Кристаллическая структура — SpringerMaterials
Получить доступ СИФ Скачать справку (pdf)
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа | У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
У вас нет доступа к этому содержимомуПараметры доступаДополнительные возможности доступа
| |||||||||
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||||||
Параметры смещения
изотропный
У вас нет доступа к этому содержимомуОпции доступаДополнительные опции доступа
| |||
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| ||||||
Детали эксперимента
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Ссылка
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
3D интерактивная структура
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Об этом контенте
PAULING FILE Multinaries Edition — 2022 г.
sd_1713508
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред. )
SpringerМатериалы
Zn(NO3)2·4h3O (Zn[NO3]2[h3O]4) Кристаллическая структура
sd_1713508 (Springer-Verlag GmbH, Гейдельберг, © 2016)
)
SpringerМатериалы
Zn(NO3)2·4h3O (Zn[NO3]2[h3O]4) Кристаллическая структура
sd_1713508 (Springer-Verlag GmbH, Гейдельберг, © 2016)
Скачать эту цитату
Цитата скопированаsd_1713508
Формула нитрата цинка – структура, свойства, использование, примеры вопросов
Цинк – это химический элемент с символом Zn и его атомным номером 30. другие химические элементы. Это важный микроэлемент в организме человека, где он содержится в высоких концентрациях в красных кровяных тельцах. Это широко используемый металл. Цинк в основном используется для цинкования других металлов, чтобы защитить их от ржавчины. Металлический цинк используется для производства, например, для создания кровельных материалов или производства оксида цинка.
Азот
Азот — химический элемент с символом N. Его атомный номер 7 и электронная конфигурация 1s 2 2s 2 2p 3 .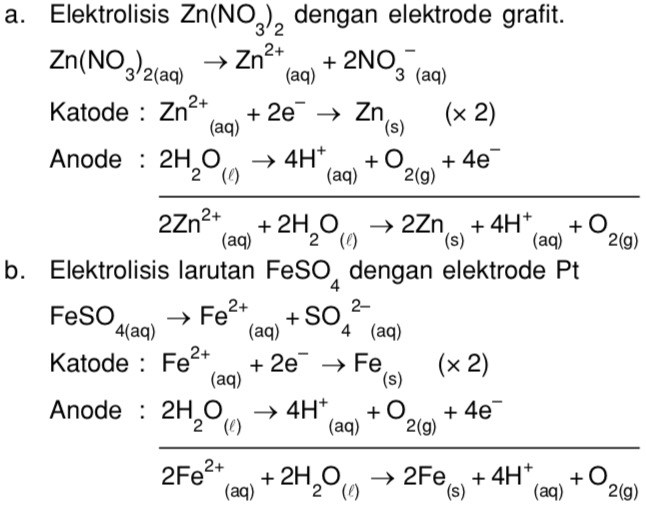 Это седьмой элемент периодической таблицы. Это важная часть аминокислот. Это одно из самых известных веществ на земле. Это важный элемент для всех форм жизни и четвертый по распространенности элемент в живой биомассе после водорода, углерода и кислорода. Он используется для производства удобрений, азотной кислоты, нейлона, красителей и взрывчатых веществ.
Это седьмой элемент периодической таблицы. Это важная часть аминокислот. Это одно из самых известных веществ на земле. Это важный элемент для всех форм жизни и четвертый по распространенности элемент в живой биомассе после водорода, углерода и кислорода. Он используется для производства удобрений, азотной кислоты, нейлона, красителей и взрывчатых веществ.
Формула нитрата цинка
Нитрат цинка представляет собой неорганическое химическое соединение с формулой Zn(NO 3 ) 2 . Это бесцветное кристаллическое твердое вещество. Он используется в качестве катализатора в производстве смолы, производстве химикатов и лекарств. Он используется в лаборатории для синтеза координационных полимеров. Нитратные соединения в основном растворимы в воде. Обычно его получают растворением цинка в азотной кислоте.
Zn + 2HNO 3 ——> Zn(NO 3 ) 2 + H 2
On heating, it undergoes thermal decomposition to form zinc oxide and oxygen
2Zn(NO 3 ) 2 ——> 2 ZnO + 4 NO 2 +O 2
Структура нитрата цинка
Химическая формула нитрата цинка: Zn(NO3)2. В этой структуре каждый атом азота содержит три атома кислорода, этот атом азота удовлетворяет правилу октета. Он состоит из двух атомов азота, шести атомов кислорода и одного атома цинка. Структура нитрата цинка приведена ниже
В этой структуре каждый атом азота содержит три атома кислорода, этот атом азота удовлетворяет правилу октета. Он состоит из двух атомов азота, шести атомов кислорода и одного атома цинка. Структура нитрата цинка приведена ниже
Приготовление нитрата цинка
- Нитрат цинка готовится растворением цинка в растворе азотной кислоты
Zn + 2 HNO 3 (разбавлен) -> ZN (№ 3 3 (разбавлен) -> ZN (№ 3 3 3 3 3 3 3 3 ). + H 2
4ZN + 10 HNO 3 (сконцентрировано) ———-> 4ZN (№ 3 ) 2 + NH 4 ) 2 + NH 4 ) 2 2 2 2 2 2 . 3 2 . O
- При нагревании подвергается термическому разложению с образованием оксида цинка, кислорода и диоксида азота
2 Zn (№ 3 ) 2 ———> 2ZNO + 4NO 2 + O 2
64.
 NITRATE г/моль
NITRATE г/мольХимические свойства нитрата цинка
- Химическая формула нитрата цинка: Zn(NO 3 ) 2
- Нитрат цинка, растворенный в воде. The reaction’s chemical equation is as follows
Zn(NO 3 ) 2 + H 2 O ——> Zn 2 + + ZNO 3 –
- Нитрат цинка реагирует с карбонатом натрия с образованием карбоната цинка и нитрата натрия. Тогда в результате образуется белый осадок.
Zn(NO 3 ) 2 + Na 2 CO 3 —–> ZnCO 3 +2 NaNO 3
Uses Of Zinc Nitrate
- Zinc Nitrate используется для синтеза координационных полимеров
- Используется как сильный окислитель
- Используется в жидких удобрениях
- Используется как отбеливатель и протрава
- Используется как протрава при окрашивании
Примеры вопросов
Вопрос 1. Какие организмы нуждаются в азоте для выживания?
Какие организмы нуждаются в азоте для выживания?
Ответ:
Азот — это химический элемент с символом N. Это важное питательное вещество для растений и важный компонент белков, необходимых всем животным для размножения и выживания. Это важный компонент и строительный блок жизни. Круговорот азота превращает азот в соединения, которые могут использовать растения и животные.
Вопрос 2: Является ли нитрат цинка кислотой или основанием?
Ответ:
Цинк азотнокислый. Анионы гидроксида, поступающие из воды, могут высвобождать анионы нитрата, когда нитрат цинка помещают в водный раствор. HNO3 не похож на молекулу. В результате реакции образуются ионы гидроксония, поэтому раствор можно считать кислым.
Вопрос 3: Растворимость нитрата цинка низкая или высокая?
Ответ:
Когда нитрат цинка выливается в воду, он не вступает в реакцию с водой.
Он диссоциирует на ионы Zn+ и NO32-. Гидроксид цинка не образуется. Таким образом, добавление нитрата цинка в воду является физическим изменением, поскольку химические свойства нитрата цинка в воде остаются такими же.
Вопрос 4: Каково применение цинка?
Ответ:
Цинк — это химический элемент с символом Zn. Металлический цинк в основном используется для гальванического покрытия железа и стали от коррозии, а также для изготовления латуни и сплавов для литья под давлением. Его использование варьируется от металлических изделий до резины и лекарств. Источниками цинка являются зерновые, устрицы, красное мясо, птица и молочные продукты.
Вопрос 5: Что происходит, когда цинк реагирует с нитратом цинка?
Ответ:
Цинк приводит к образованию нитрата цинка с нитратом серебра и дает серебро в качестве побочного продукта во время или в конце процесса.

 Он диссоциирует на ионы Zn+ и NO32-. Гидроксид цинка не образуется. Таким образом, добавление нитрата цинка в воду является физическим изменением, поскольку химические свойства нитрата цинка в воде остаются такими же.
Он диссоциирует на ионы Zn+ и NO32-. Гидроксид цинка не образуется. Таким образом, добавление нитрата цинка в воду является физическим изменением, поскольку химические свойства нитрата цинка в воде остаются такими же.