Калькулятор молярной массы, молекулярной массы и строения элементов
| |||||
ru.webqc.org
Непредельные углеводороды. Алкены
Простейшим алкеном является этен C2H4.По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Пространственная структура этилена
По названию первого представителя этого ряда — этилена — такие углеводороды называют этиленовыми.
Номенклатура и изомерия
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен : этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С = СН — — винил (этенил)
Н2С = CН — СН2— -аллил (пропенил-2)
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Первые два члена гомологического ряда алкенов -(этилен и пропилен) — изомеров не имеют и их строение можно выразить так:
H2C = CH2 этилен (этен)
H2C = CH — CH3 пропилен (пропен)
H2C = CH — CH2 — CH3 бутен-1
H3C — CH = CH — CH3 бутен-2Такая изомерия характерна для соединений с двойной связью.
Если простая σ -связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс-) изомеров.
Геометрическая изомерия — один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами,а по разную — транс-изомерами:
Цис- и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс-изомеры более устойчивы, чем цис-изомеры.
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.
В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr2О3).
H3C — CH2 — CH2 — CH3 → H2C = CH — CH2 — CH3 + H2↑ (бутен-1)
бутан
H3C — CH2 — CH2 — CH3 → H3C — CH = CH — CH3 + H2↑ (бутен-2)
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование ацетилена в присутствии катализатора (Pd):
H-C ≡ C-H + H2 → H2C = CH2
3. Дегидратация спиртов (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
В таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродною атома (правило А.М.Зайцева):
Физические свойства
Физические свойства некоторых алкенов показаны в таблице ниже. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10 (амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Название | Формула |
| t кип,°С | d204 |
Этилен (этен) | С2Н4 | -169,1 | -103,7 | 0,5700 |
Пропилен (пропен) | С3Н6 | -187,6 | -47,7 | 0,5193* |
Бутилен (бутен-1) | C4H8 | -185,3 | -6,3 | 0,5951 |
Цис-бутен-2 | С4Н8 | -138,9 | 3,7 | 0,6213 |
Транс-бутен-2 | С4Н8 | -105,5 | 0,9 | 0,6042 |
Изобутилен (2-метилпропен) | С4Н8 | -140,4 | -7,0 | 0,5942* |
Амилен (пентен-1) | C5H10 | -165,2 | +30,1 | 0,6405 |
Гексилен (гексен-1) | С6Н12 | -139,8 | 63,5 | 0,6730 |
Гептилен (гептен-1) | C7H14 | -119 | 93,6 | 0,6970 |
Октилен (октен-1) | C8H16 | -101,7 | 121,3 | 0,7140 |
Нонилен (нонен-1) | C9H18 | -81,4 | 146,8 | 0,7290 |
Децилен (децен-1) | С10Н20 | -66,3 | 170,6 | 0,7410 |
* Жидкий
Алкены малополярны, но легко поляризуются.
Химические свойства
Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью.
π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:
Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (с сохранением σ-связи).
Для алкенов, кроме присоединения, характерны еще реакции окисления и полимеризации.
Реакции присоединения
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды — алканы:
Н2С = СН2 + H2→ Н3С — СН3 (этан)
этилен
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н2С = СН2 + Cl2 → ClH2C — CH2Cl (1,2-дихлорэтан)
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.
Сравните: у алкенов реакция галогенирования — процесс присоединения, а не замещения (как у алканов).
Реакцию галогенирования обычно проводят в растворителе при обычной температуре.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.
Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р-орбиталь sp2-гибридизованного атома углерода перекрывается с р-орбиталью «неподеленной пары» электронов атома галогена, образуя циклический ион бромония.
На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic-рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение SN2 у атома углерода, где уходящей группой является Br+.
Результат этой реакции нетрудно предвидеть: анион брома атакует карбкатион с образованием дибромэтана.
Быстрое обесцвечивание раствора брома в СCl4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
Присоединение брома к алкенам (реакция бромирования) — качественная реакция на предельные углеводороды. При пропускании через бромную воду (раствор брома в воде) непредельных углеводородов желтая окраска исчезает (в случае предельных — сохраняется).
3. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогенводороды:
H2С = СН2 + НВr → Н3С — CH2Вr
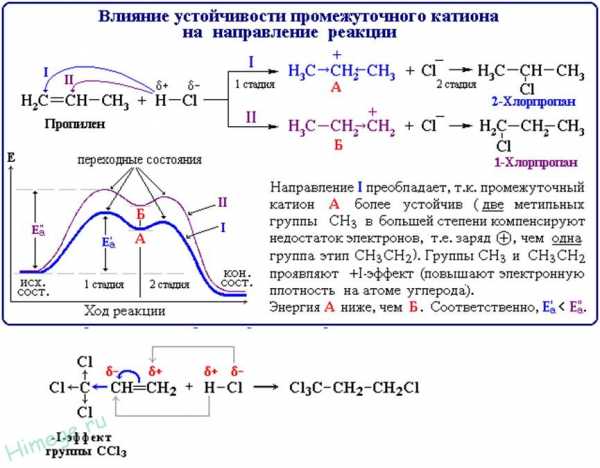
Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова (1837 — 1904): при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген — к менее гидрогенизированному:
Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Под влиянием метильной группы, связанной непосредственно с двойной связью, происходит смещение электронной плотности в сторону этой связи (на крайний углеродный атом).
Вследствие такого смещения p-связь поляризуется и на углеродных атомах возникают частичные заряды. Легко представить, что положительно заряженный ион водорода (протон) присоединится к атому углерода (электрофильное присоединение), имеющему частичный отрицательный заряд, а анион брома — к углероду с частичным положительным зарядом.
Такое присоединение является следствием взаимного влияния атомов в органической молекуле. Как известно, электроотрицательность атома углерода немного выше, чем водорода.
Поэтому в метильной группе наблюдается некоторая поляризация σ-связей С-Н, связанная со смещением электронной плотности от водородных атомов к углероду. В свою очередь это вызывает повышение электронной плотности в области двойной связи и особенно на ее крайнем, атоме. Таким образом, метильная группа, как и другие алкильные группы, выступает в качестве донора электронов. Однако в присутствии пероксидных соединений или О2 (когда реакция имеет радикальный характер) эта реакция может идти и против правила Марковникова.
По тем же причинам правило Марковникова соблюдается при присоединении к несимметричным алкенам не только галогеноводородов, но и других электрофильных реагентов (H2O, H2SО4, НОСl, ICl и др.).
4. Гидратация (присоединение воды). В присутствии катализаторов [H2SO4 (конц.) и др.] к алкенам присоединяется вода с образованием спиртов. Например:
H3C — CH = CH2 + H — OH → H3C — CHOH — CH3 (изопропиловый спирт)
Реакции окисления
Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Горение
Н2С = СН2 + 3O2 → 2СO2 + 2Н2O
2. Неполное каталитическое окисление
3. Окисление при обычной температуре. При действии на этилен водного раствора КМnO4 (при нормальных условиях, в нейтральной или щелочной среде — реакция Вагнера) происходит образование двухатомного спирта — этиленгликоля:
3H2C = CH2 + 2KMnO4 + 4H2O → 3HOCH2 — CH2OH (этиленгликоль)+ 2MnO2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
В более жестких условиях (окисление КМnO4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов:
H3C — CH = CH — CH3 + 2O2 → 2H3C — COOH (уксусная кислота)
Реакция изомеризации
При нагревании или в присутствии катализаторов алкены способны изомеризоваться — происходит перемещение двойной связи или установление изостроения.
Реакции полимеризации
За счет разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.
Нахождение в природе и физиологическая роль алкенов
В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений — этилен C2H4 — является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов — мускалур (цис-трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).
Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей
Отдельные представители
Этилен (этен) — органическое химическое соединение,описываемое формулой С2H4. Является простейшим алкеном . Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном (низкомолекулярные органические вещества, вырабатываемые растениями и имеющие регуляторные функции).
Этилен — вызывает наркоз, обладает раздражающим и мутагенным действием.
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3% в год.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения полиэтилена (1-е место, до 60 % всего объёма).
Полиэтилен — термопластичный полимер этилена . Самый распространенный в мире пластик.
Представляет собой воскообразную массу белого цвета (тонкие листы прозрачный бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80-120°С), при охлаждении застывает, адгезия (сцепление поверхностей разнородных твёрдых и/или жидких тел) — чрезвычайно низкая. Иногда в народном сознании отождествляется с целлофаном — похожим материалом растительного происхождения.
Пропилен — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Со временем, происходит термостарение.
— Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч ).
— Тара ( бутылки , банки , ящики , канистры , садовые лейки , горшки для рассады.
— Полимерные трубы для канализации , дренажа , водо-, газоснабжения.
— Электроизоляционный материал.
— Полиэтиленовый порошок используется как термоклей.
Бутен-2 — вызывает наркоз, обладает раздражающим действием.
examchemistry.com
Алкены — номенклатура, получение, характерные химические свойства » HimEge.ru
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.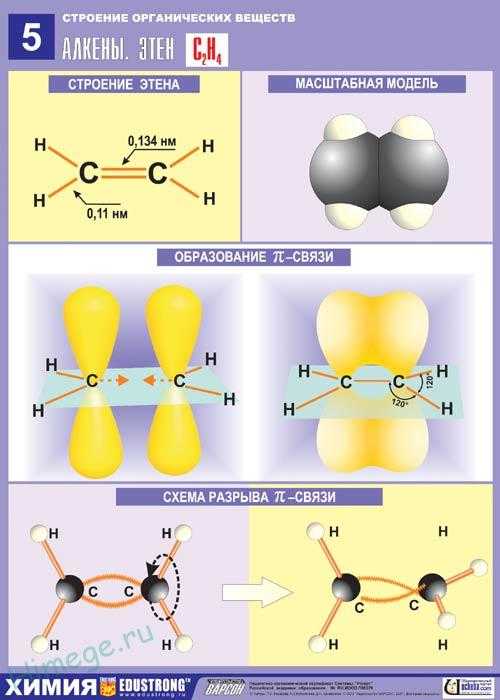
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Строение этилена
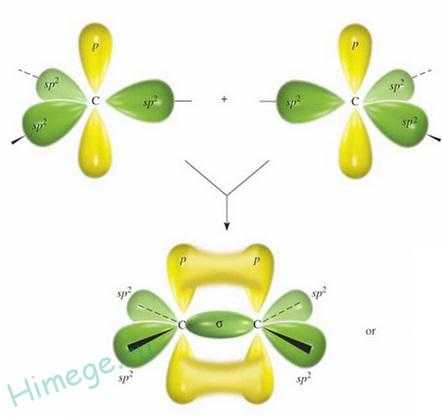
Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.
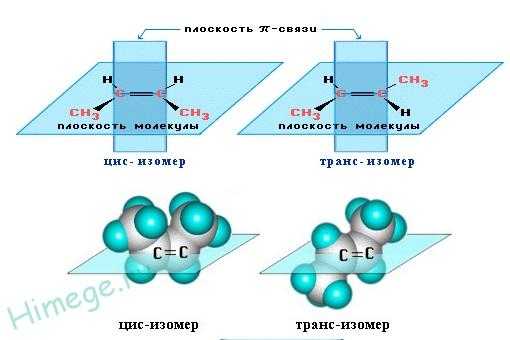
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:
5-метилгексен-2
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:
Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
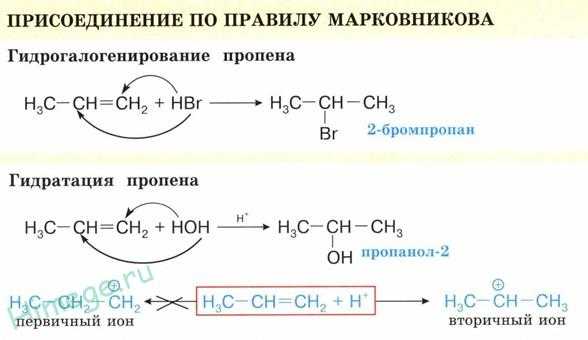
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:
2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:



himege.ru
Нужны все изомеры к алкину С6Н10 и их названия, СРОЧНО
1) CH=C-Ch3-Ch3-Ch3-Ch4 гексин-1 (вместо двойной связи надо писать тройную, Ответы не позволяют) 2) Ch4-C=C-Ch3-Ch3-Ch4 гексин-2 (вместо двойной связи надо писать тройную, Ответы не позволяют) 3) Ch4-Ch3-C=C-Ch3-Ch4 гексин-3 (вместо двойной связи надо писать тройную, Ответы не позволяют) 4) CH=C-C-C(Ch4)-Ch4 4-метилпентин-1 (вместо двойной связи надо писать тройную, Ответы не позволяют) 5) Ch4-C=C-C(Сh4)-Ch4 4-метилпентин-2 (вместо двойной связи надо писать тройную, Ответы не позволяют) 6) СH=C-CH(Ch4)-Ch3-Ch4 метилпентин-1 (вместо двойной связи надо писать тройную, Ответы не позволяют) 7) СH=C-C(Ch4)2-Ch4 3,3-диметилбутин-1 (вместо двойной связи надо писать тройную, Ответы не позволяют) Кроме этого алкинам изомерны алкадиены 8) Сh3=С=СH-Сh3-Сh3-Сh4 гексадиен-1,2 9) Сh3=СH-СH=СH-Сh3-Сh4 гексадиен-1,3 10) Сh3=СH-Сh3-СH=СH-Сh4 гексадиен-1,4 11) Сh3=СH-Сh3-Сh3-СH=Сh3 гексадиен-1,5 12) Сh3=С=С (Ch4)-Сh3-Сh4 3-метилпентадиен-1,2 13) Сh3=С=СH-СH(Ch4)-Сh4 4-метилпентадиен-1,2 Дальше надоело писать
Общая формула диеновых углеводородов Cnh3n-2 C3h5 — пропадиен C4H6 — бутадиен C5H8 — пентадиен C6h20 — гексадиен C7h22 — гептадиен C8h24 — октадиен C9h26 — нонадиен C10h28 — декадиен
1.CHCCh3Ch3Ch3Ch4 гексин-1 2.Ch4CCCh3Ch3Ch4 гексин — 2 3.Ch4Ch3CCCh3Ch4 гексин — 3 4.Ch4CH(Ch4)CCCh4 4-метилпентин — 2 5.Ch4CH(Ch4)Ch3CCH 4-метилпентин — 1 6.Сh4Ch3CH(Ch4)CCH 3 — метилпентин — 1 7.Сh4C(Ch4)2CCH 3,3 — диметилбутин — 1
touch.otvet.mail.ru
Кетоны
Общая формула и название
Общая формула кетонов: R1-CO-R2.
По номенклатуре ИЮПАК, названия кетонов образуют путем присоединения к названию соответствующих углеводородов суффикса «он» или к названию радикалов, связанных с кетогруппой С=О, слова «кетон»; при наличии старшей группы кетогруппу обозначают префиксом «оксо». Например, соединения СН3-СН2-СО-СН2-СН2-СН3 называется 3-гексанон или этилпропилкетон, соединения СН3-СО-СН2-СН2-СООН — 4-оксопентановая кислота. Для некоторых кетонов приняты тривиальные названия.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Особый класс циклических ненасыщенных дикетонов — хиноны.
Физические свойства
Простейшие кетоны являются бесцветными, летучими жидкостями, которые растворяются в воде. Кетоны обладают приятным запахом. Высшие кетоны — твердые, легкоплавкие вещества. Газообразных кетонов не бывает, так как уже простейший из них (ацетон) — жидкость. Многие химические свойства, характерные для альдегидов, проявляюся и у кетонов.
Кето-енольная таутомерия
Таутомерия — тип изомерии, при которой происходит быстрое самопроизвольное обратимое взаимопревращение структурных изомеров — таутомеров. Процесс взаимопревращения таутомеров называется таутомеризацией.
Кетоны, которые имеют по крайней мере один α-водородный атом, подвергаются кето-енольной таутомеризации.
Для оксосоединений, имеющих атом водорода в α-положении по отношннию к карбонильной группе, существует равновесие между таутомерными формами. Для подавляющего большинства оксосоединений это равновесие смещено в сторону кето-формы. Процесс перехода кето-формы в енольную называют енолизацией . На этом основана способность таких кетонов реагировать как С-или О-нуклеофилы. Концентрация енольной формы зависит от строения кетонов и составляет (в %): 0,0025 (ацетон), 2 (циклогексанон), 80 (ацетилацетон). Скорость енолизации возрастает в присутствии кислот и оснований.
Химические свойства
По степени окисленности кетоны, как и альдегиды, занимают промежуточное положение между спиртами и кислотами, что во многом определяет их химические свойства. 1. Кетоны восстанавливаются до вторичных спиртов гидридами металлов, например LiAlH4 или NaBH4, водородом (кат. Ni, Pd), изопропанолом в присутствии алкоголята Аl (реакцияция Меервейна-Понндорфа-Верлея).
R2CO + 2H → R2CH(OH)
2. При восстановлении кетонов натрием или электрохимически (катодное восстановление) образуются пинаконы.
2R2CO + 2H → R2CH(OH)-CR2(OH)
3. При взаимодействии кетонов с амальгамированным Zn и концентрированной НCl (реакция Клемменсена) или с гидразином в щелочной среде (реакция Кижнера — Вольфа) группа С=О восстанавливается до СН2.
4. Окисление кетонов
В отличие от альдегидов, многие кетоны устойчивы при хранении к действию кислорода. Кетоны, содержащие α-метиленовую группу, окисляются SeO2 до 1,2-дикетонов, более энергичными окислителями, напр. КМnО4 — до смеси карбоновых кислот. Циклические кетоны при взаимодействии с HNO3 или КМnО4 подвергаются окислительному расщеплению цикла, например, из циклогексанона образуется адипиновая кислота. Линейные кетоны окисляются надкислотами до сложных эфиров, циклические — до лактонов (реакция Байера — Виллигера).
Если в качестве окислителя используют, например, хромовую смесь (смесь концентрированной серной кислоты и насыщенного раствора дихромата калия) при нагревании. Окисление кетонов всегда сопровождается разрывом углерод-углеродных связей, в результате образуется, в зависимости от строения исходного кетона, смесь кислот и кетонов с меньшим числом атомов углерода. Окисление протекает по схеме:
В первую очередь окисляется углерод в α-положении по отношению к карбонильной группе, как правило, наименее гидрогенизированный. Если кетон является метилкетоном, то одним из продуктов его окисления будет углекислый газ. Связь между соседними карбонильными углеродами легко рвется, в результате:
Окисление кетонов до карбоновых кислот не может происходить без расщепления углеродного скелета и требует более жестких условий, чем окисление альдегидов. А. Н. Попов, изучавший окисление кетонов, показал, что из несимметрично построенного кетона при окислении могут образоваться все четыре возможные карбоновые кислоты (правило Попова):
Если кетон содержит в α-положении третичный углеродный атом, то в результате окисления образуются три карбоновые кислоты и новый кетон, который в зависимости от условий может или подвергнуться дальнейшему окислению, или остаться неизмененным:
5. Альдольная и кретоновая конденсации
Кетоны образуют продукты замещения α-атомов Н при галогенировании действием Вr2, N-бромсукцинимидом, SO2Cl2, при тиилировании дисульфидами. При алкилировании и ацилировании енолятов кетонов образуются либо продукты замещения α-атомов Н в кетонах, либо О-производные енолов. Большое значение в органическом синтезе имеют альдольная и кретоновая конденсации, например:
При конденсации с альдегидами кетоны реагируют главным образом как СН-кислоты, например из кетонов и СН2О в присутствии основания получают α, β-ненасыщенные кетоны:
RCOCH3 + СН2О → RCOCH=CH2 + Н2О
Вследствие полярности карбонильной группы
кетоны могут вступать в реакции как С-электрофилы, например при конденсации с производными карбоновых кислот (конденсация Штоббе, реакция Дарзана и т. п.):
(CH3)2CO + (C2H5OOCCH2)2 + (CH3)3COK → (CH3)2=C(COOC2H5)CH2COOK + C2H5OH + (CH3)3COH
Особенно легко нуклеофильной атаке подвергаются α,β-непределъные кетоны, но в этом случае атакуется двойная связь (раекция Михаэля), например:
6. Взаимодействие с илидами
При взаимодействии с илидами Р (алкилиденфосфоранами) кетоны обменивают атом О на алкилиденовую группу (реакция Виттига):
R2C=O + Ph3P=CHR’ → R2C=CHR’ + Ph3PO
7. С циклопентадиеном кетоны образуют фульвены, например:
8. При конденсации кетонов с гидроксиламином получаются кетоксимы R2C=NOH, с гидразином — гидразоны R2C=N—NH2 и азины R2C=N—N=CR2, с первичными аминами — Шиффовы основания R2C=NR’, со вторичными аминами — енамины.
9. Присоединение по карбонильной групе
Кетоны способны присоединять по карбонильной группе воду, спирты, бисульфит Na, амины и другие нуклеофилы, хотя эти реакции протекают не так легко, как в случае альдегидов.
Поскольку в спиртовых растворах равновесие между кетоном и его полукеталем сильно смещено влево, получить кетали из кетонов и спиртов трудно:
RCOR’ + R»OH ↔ RR’C(OH)OR»
Для этой цели используют реакцию кетонов с эфирами ортомуравьиной кислоты. Кетоны взаимодействуют с С-нуклеофилами, например с литий-, цинк- или магнийорганические соединения, а также с ацетиленами в присутствии оснований (реакция Фаворского), образуя третичные спирты:
В присутствии оснований к кетонам присоединяется HCN, давая α-гидроксинитрилы (циангидрины):
R2C=O + HCN → R2C(OH)CN
При катализе кислотами кетоны реагируют как С-электрофилы с ароматическими соединениями, например:
Гомолитическое присоединение кетонов к олефинам приводит к α-алкилзамещенным кетонам, фотоциклoприсоединение к оксетанам, например:
Получение кетонов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью вторичные спирты распадаются — на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
CH3-CO-Cl + 2H → CH3-CHO + HCl
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
2CH3-COOH → CH3-CO-CH3 + H2O + CO2
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
CH3-C≡CH + H2O → CH3-CO-CH3
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
R-CO-Cl + C2H5CdBr → R-CO-C2Н5 + CdClBr
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
В процессе фотосинтеза 1,5-дифосфат-D-эритро-пентулозы (фосфолированная кетопентоза) является катализатором. Ацетоуксусная кислота — промежуточный продукт в цикле Креббса.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
examchemistry.com
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
scienceforyou.ru
Тривиальные названия органических веществ (подготовка к ЕГЭ, 10 класс)
Тривиальные названия органических веществ
Тривиальная номенклатура используется, в основном, в химии, биологии и в объединении этих двух дисциплин — медицине. Она появились задолго до введения общей системы IUAC (ИЮПАК), которая стала международным общепринятым и общепонятным вариантом.
Исторически тривиальные названия применялись для обозначения веществ, используемых в практической деятельности, и их названия отражали внешний вид или особое свойство, реальное или вымышленное.
Типичный пример – алмаз. По-гречески damasma – покорение, укрощение, damao – сокрушаю; соответственно, adamas – несокрушимый (интересно, что и по-арабски «аль-мас» – твердейший, самый твердый). Многие тривиальные названия введены алхимиками. Они могут иметь разный смысл в различных промышленных областях или регионах.
Надо понимать, что тривиальные названия любых веществ, не только органических, не отображают состав или химические свойства вещества.
Используют их не только профессионалы этих областей, но и мы — в быту
например, бытовое название сахар используется для обозначения дисахарида сахарозы, имеющего систематическое наименование α-D-глюкопиранозил-β-D-фруктофуранозид.
Здесь будут приведены названия веществ, встречающиеся в школьном курсе химии
Тривиальные названия органических веществ
Тривиальное название
Структурная формула
Систематическое название
Ацетилен
CH ≡ CH
Этин
Анилин
Фениламин
Бензиловый спирт
Винилацетилен
Ch3 = CH — C ≡ CH
Бутен-1-ин-3
Дивинил
h3C = CH — CH = Ch3
Бутадиен-1,3
Изобутан
2-метилпропан
Изопрен
2-метилбутадиен-1,3
Крезол
Метилфенол
Ксилол
Диметилбензол
Кумол
Изопропилбензол
Пирогаллол
1,2,3-тригидроксибензол
Пирокатехин
1,2-дигидроксибензол
Пропилен
Ch3 = CH- Ch4
Пропен
Стирол
Винилбензол
Толуол
Метилбензол
Хлоропрен
2-хлорбутадиен-1,3
Этилен
Сh3 = Ch3
Этен
Глицерин
Пентантриол
Глицерат меди
Нитроглицерин
Этиленгликоль
Этандиол
Тротил*
*
2,4,6 – тринитротолуол*
Названиекислоты
Структурная формула
Систематическое название
Названия солей и эфиров
Муравьиная кислота
HCOOH
Метановая кислота*
Формиат
Уксусная кислота
Ch4COOH
Этановая кислота*
Ацетат
Пропионовая кислота
C2H5-COOH
Пропановая кислота*
Пропионат
Масляная кислота
C3H7-COOH
Бутановая кислота*
Бутират
Валериановая кислота
C4H9-COOH
Пентановая кислота*
Валерат
Капроновая кислота
C5h21-COOH
Гексановая кислота*
Щавелевая кислота
HOOC-COOH
Этандиовая кислота*
Оксалат
Бензойная кислота
C6H5-COOH
Фенилуксусная кислота*
Бензоат
Акриловая кислота
h3C = CH-COOH
Пропеновая кислота*
Акрилат
Линолевая кислота
C17h41COOH
Линолеат
Олеиновая кислота
C17h43COOH
Олеат
Пальмитиновая кислота
C15h41COOH
Пальмитат
Пикриновая кислота
2,4,6-тринитрофенол
Пикрат*
Стеариновая кислота
C17h45COOH
Стеарат
Фталевая кислота
Фталат
Терефталевая кислота
Терефталат
Молочная кислота
2-гидроксипропановая
Лактат
Глицин
h3N-Ch3-COOH
Аминоуксусная кислота
Аминоацетат*
Аланин
2-аминопропионовая кислота
Аминопропионат*
Название альдегида
Структурная формула
Систематическое название
Формальдегид
HCOH
Метаналь
Ацетальдегид
Ch4COH
Этаналь
Название радикала
Структурная форма радикала
Изопропил
Бензил
Винил
h3C = CH —
Тривиальные названия органических веществ
В приведенном списке первое название – тривиальное, после химической формулы указывается систематическое название вещества.
Данные названия потребуются всем учащимся, сдающим ЕГЭ по химии
Альдегид муравьиный, формальдегид НСНО – метаналь. Раствор формальдегида в воде называется формалином.
Фосген COCl2 — карбонил-хлорид, оксид-дихлорид углерода
Альдегид уксусный, ацетальдегид СН3-СНО – этаналь
Аминокислоты
1. Аланин CH2–CH(NН2)–COOH – α-аминопропионовая кислота
2. Глицин H2N–CH2–COOH – аминоуксусная кислота
3. Глутаминовая кислота НООС–СН2–СН2–СН(NН2)–COOH – α-аминоглутаровая кислота
4. Лизин NH2–CH2–CH2–CH2–CH2–CH(NН2)–COOH – α,ε-диаминокапроновая кислота
5. Серин ОН–СН2–СН(NН2)–COOH – α-амино-β-оксипропионовая кислота
6. Тирозин ОН-С6Н4–СН2–СН(NН2)–COOH – β-(пара-оксифенил)-α-аминопропионовая кислота
7. Фенилаланин С6Н5–СН2–СН(NН2)–COOH – α-амино-β-фенилпропионовая кислота
8. Цистеин HS-СН2–СН(NН2)–COOH – α-амино-β-тиопропионовая кислота
Примечание: из аминокислот необходимо знать систематические названия только аминоуксусной и аминопропионовой кислот, для остальных – только тривиальные.Анилин С6Н5-NН2 – фениламин
Ацетилен СН≡СН – этин
Ацетон СН3-С(О)-СН3 – пропанон
Винилацетилен СН≡С–СН=СН2 – 1-бутен-3-ин
Винный спирт С2Н5ОН – этанол
Виноградный сахар С6Н12О6 – глюкоза
Гидрохинон НО-С6Н4-ОН – 1,4-дигидроксибензол
Глицерин HO–CH2-СН(ОН)-CH2–OH – пропантриол-1,2,3
Глицериды – сложные эфиры глицерина и органических или минеральных кислот. Триглицериды карбоновых кислот (С4-С18) – входят в состав растительных и животных жиров.
Дивинил СН2=СН-СН=СН2 – бутадиен-1,3
Древесный спирт СН3ОН – метанол
Изопрен СН2=С(СН3)-СН=СН2 – 2-метилбутадиен-1,3
Кислоты карбоновые предельные
1. Муравьиная кислота НСООН – метановая кислота
2. Уксусная кислота СН3СООН – этановая кислота
3. Пропионовая кислота СН3СН2СООН – пропановая кислота
4. Масляная кислота СН3СН2СН2СООН – бутановая кислота
5. Валериановая кислота СН3СН2СН2СН2СООН – пентановая кислота
6. Капроновая кислота СН3СН2СН2СН2СН2СООН – гексановая кислота
7. Пальмитиновая кислота С15Н31СООН, CH3(CH2)14COOH
8. Стеариновая кислота С17Н35СООН, CH3(CH2)16COOHКислоты карбоновые непредельные
1. Акриловая кислота CH2=CH–COOH – пропеновая кислота
2. Метакриловая кислота СН2=С(СН3)-СООН – 2-метилпропеновая кислота
3. Кислота олеиновая СН3(СН2)7СН=СН(СН2)7СООН, С17Н33СООН (одна двойная С-С связь)
4. Кислота линолевая CH3(CH2)3CH2CH=CH-CH2CH=CH-(CH2)7COOH, С17Н31СООН, (две двойные С-С связи)
5. Кислота линоленовая (три двойные С-С связи) С17Н29СООН,
CH3-CH2CH=CH-CH2CH=CH-CH2CH=CH-(CH2)7COOHКислоты другие
1. Щавелевая кислота НООС-СООН – этандиовая кислота
2. Молочная кислота CH3-CH(OH)-COOH – 2-гидроксипропановая кислота
3. Фталевая (о-фталевая) кислота НООС-C6H4-COOH – 1,2-бензолдикарбоновая кислота
4. Изофталевая (м-фталевая) кислота НООС-C6H4-COOH – 1,3-бензолдикарбоновая кислота
5. Терефталевая (п-фталевая) кислота НООС-C6H4-COOH – 1,4-бензолдикарбоновая кислотаКсилол СН3-С6Н4-СН3 – диметилбензол (существует 3 изомера: 1,2/1,3/1,4-диметилбензолы)
Крезол СН3-С6Н4-ОН – гидроксиметилбензол (существует 3 изомера: 1,2/1,3/1,4)
Кумол С6Н5-СН(СН3)2 – изопропилбензол
Парафины CnH2n+2 – алканы
Пикриновая кислота НО-С6Н2-(NО2)3 – 2,4,6-тринитрофенол
Плодовый сахар С6Н12О6 – фруктоза
Пирокахетин НО-С6Н4-ОН – 1,2-дигидроксибензол
Резорцин НО-С6Н4-ОН – 1,3-дигидроксибензол
Стирол C6H5-CH=CH2 – винилбензол
Толуол С6Н5-СН3 – метилбензол
Фенол (карболовая кислота) С6Н5-ОН – гидроксибензол
Циклопарафины CnH2n – циклоалканы
Хлоропрен СН2=ССlСН=СН2 – 2-хлор-1,3-бутадиен
Хлороформ СНСl3 – трихлорметан
Этиленгликоль HO–CH2-CH2–OH – этандиол-1,2
infourok.ru
