Относительная молярная и молекулярная массы вещества. Молярный объем вещества
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Зная относительные молекулярные массы газообразных веществ, можно сравнивать их плотности, т. е. вычислять относительную плотность одного газа по другому – D(А/Б). Относительная плотность газа А по газу Б равна отношению их относительных молекулярных масс:
Вычислим относительную плотность углекислого газа по водороду:
.
Теперь вычисляем относительную плотность углекислого газа по водороду:
D(угл. г./водор.) = Mr(угл. г.) : Mr(водор.) = 44:2 = 22.
Таким образом, углекислый газ в 22 раза тяжелее водорода.
Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса.
Молярная масса обозначается М, она численно равна относительной молекулярной массе.
Отношение массы вещества к его молярной массе называется количеством вещества.
Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях.
Слово «моль» происходит от слова «молекула». Число молекул в равных количествах вещества одинаково.
Экспериментально установлено, что 1 моль вещества содержит частиц (например, молекул). Это число называется числом Авогадро. А если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества.
В соответствии с законом Авогадро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn.
При нормальных условиях (а это 0 °С и нормальное давление – 1 атм. или 760 мм рт. ст. или 101,3 кПа) молярный объем равен 22,4 л/моль.
Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.
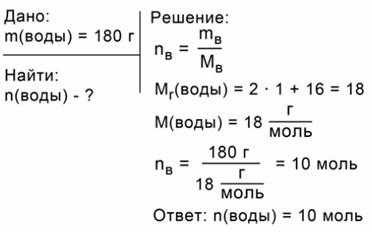
ЗАДАЧА 1. Какое количество вещества соответствует 180 г воды?
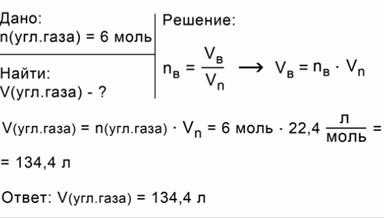
ЗАДАЧА 2. Вычислим объем при н.у., который займет углекислый газ количеством 6 моль.
Список литературы
- Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006. (с. 29–34)
- Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006. (с. 27–32)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§§ 12, 13)
- Химия: неорг. химия: учеб. для 8 кл. общеобр.учрежд. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§ 10, 17)
- Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
- Тесты по химии (онлайн) (Источник).
Домашнее задание
1. с.69 № 3; с.73 №№ 1, 2, 4 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. №№ 65, 66, 71, 72 из Сборника задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
1.3.3. Моль, молярная масса, молярный объем
Одной из основных единиц в Международной системе единиц (СИ) является единица количества вещества – моль.
Моль – это такое количество вещества, которое содержит столько структурных единиц данного вещества (молекул, атомов, ионов и др.), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа углерода 12С.
Учитывая, что значение абсолютной атомной массы для углерода равно m(C) = 1,99·1026 кг, можно рассчитать число атомов углерода NА, содержащееся в 0,012 кг углерода.
Моль любого вещества содержит одно и то же число частиц этого вещества (структурных единиц). Число структурных единиц, содержащихся в веществе количеством один моль равно 6,02·1023 и называется числом Авогадро (NА).
Например, один моль меди содержит 6,02·1023 атомов меди (Cu), а один моль водорода (H2) – 6,02·1023 молекул водорода.
Молярной массой (M) называется масса вещества, взятого в количестве 1 моль.
Молярная масса обозначается буквой М и имеет размерность [г/моль]. В физике пользуются размерностью [кг/кмоль].
В общем случае численное значение молярной массы вещества численно совпадает со значением его относительной молекулярной (относительной атомной) массы.
Например, относительная молекулярная масса воды равна:
Мr(Н2О) = 2Аr (Н) + Аr (O) = 2∙1 + 16 = 18 а.е.м.
Молярная масса воды имеет ту же величину, но выражена в г/моль:
М (Н2О) = 18 г/моль.
Таким образом, моль воды, содержащий 6,02·1023 молекул воды (соответственно 2·6,02·1023 атомов водорода и 6,02·1023 атомов кислорода), имеет массу 18 граммов. В воде, количеством вещества 1 моль, содержится 2 моль атомов водорода и один моль атомов кислорода.
1.3.4. Связь между массой вещества и его количеством
Зная массу вещества и его химическую формулу, а значит и значение его молярной массы, можно определить количество вещества и, наоборот, зная количество вещества, можно определить его массу. Для подобных расчетов следует пользоваться формулами:
ν = m / M,
m = ν · M,
где ν – количество вещества, [моль]; m – масса вещества, [г] или [кг]; М – молярная масса вещества, [г/моль] или [кг/кмоль].
Например, для нахождения массы сульфата натрия (Na 2SO4) количеством 5 моль найдем:
1) значение относительной молекулярной массы Na2SO4, представляющую собой сумму округленных значений относительных атомных масс:
Мr(Na2SO4) = 2Аr(Na) + Аr(S) + 4Аr(O) = 142,
2) численно равное ей значение молярной массы вещества:
М(Na2SO4) = 142 г/моль,
3) и, наконец, массу 5 моль сульфата натрия:
m = ν · M = 5 моль · 142 г/моль = 710 г.
Ответ: 710.
1.3.5. Связь между объемом вещества и его количеством
При нормальных условиях (н.у.), т.е. при давлении р, равном 101325 Па (760 мм. рт. ст.), и температуре Т, равной 273,15 К (0С), один моль различных газов и паров занимает один и тот же объем, равный 22,4 л.
Объем, занимаемый 1 моль газа или пара при н.у., называется молярным объемом газа и имеет размерность литр на моль.
Vмол = 22,4 л/моль.
Зная количество газообразного вещества (ν) и значение молярного объема (Vмол) можно рассчитать его объем (V) при нормальных условиях:
V = ν · Vмол,
где ν – количество вещества [моль]; V – объем газообразного вещества [л]; Vмол = 22,4 л/моль.
И, наоборот, зная объем (V) газообразного вещества при нормальных условиях, можно рассчитать его количество (ν):
ν = V /Vмол.
studfiles.net
Молярная масса в химии
Понятие молярная масса
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
Атомная масса и относительная атомная масса элемента
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12С.
1 а.е.м. = 1/12 m(12С) = 1,66057×10-27 кг = 1,66057×10-24 г.
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35Сl (75,5%) и 37Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m(35Сl) + 0,245×m(37Сl)) / (1/12×m(12
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
m(Cl) = 35,5 ×1,66057×10-24 = 5,89×10-23 г.
Относительная молекулярная масса элемента
Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Mr(N2O) = 2×Ar(N) + Ar(O) = 2×14,0067 + 15,9994 = 44,0128.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12С.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро.
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Примеры решения задач
ru.solverbook.com
Молярная масса вещества онлайн
| Молярная масса вещества (Грамм/Моль) |
| Формула химического вещества |
Введение в химические формулы
Не секрет , что химические знаки позволяют изобразить состав сложного вещества в виде формул.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Формулы различают молекулярные, структурные, электронные и другие.
Молекулярные формулы (h4P04, Fe203, А1(ОН)3, Na2S04, 02 и т.д.) показывают качественный (т.е. из каких элементов состоит вещество) и количественный (т.е. сколько атомов каждого элемента имеются в веществе) состав.
Структурные формулы показывают порядок соединения атомов в молекуле, соединяя атомы черточками (одна черточка — одна химическая связь между двумя атомами в молекуле).
Относительная атомная и молекуряная масса
Относительная атомная масса вещестав или элемента — это безразмерная величина. Почему безразмерная, ведь масса должна иметь размерность?
Причина в том что атомная масса вещества в кг очень мала и выражается порядком 10 в минус 27 степени. Что бы в расчетах не учитывать этот показатель, массу каждого элемента привели к отношению 1/12 массы изотопа углерода. По этой причине относительная атомная масса углерода и составляет 12 единиц.
Современные значения относительных атомных масс приведены в периодической системе элементов Д.И.Менделеева. Для большинства элементов указаны
среднеарифметические значения атомных масс природной смеси изотопов этих элементов.
Например, относительная масса водорода равна 1, а кислорода 16.
Относительная молекулярная масса простых и сложных веществ численно равна сумме относительных атомных масс атомов, входящих в состав молекулы.
Например, относительная молекулярная масса воды , состоящей из двух атомов водорода и одного атома кислорода, равна
1*2+16 =18
По химической формуле можно вычислить как химический состав, так и молекулярную массу.
Определяемый по химическим формулам количественный состав имеет огромное значение для многочисленных расчетов, которые производятся по химическому составу.
Вычисление относительной молекулярной массы вещества по химической формуле производится путем сложения произведений относительных атомных масс элементов на соответствующие индексы в химической формуле.
Как рассчитывается молекулярная масса вещества мы рассмотрели чуть выше.
И именно эту задачу автоматизирует наш химический калькулятор.
Зная молекулярную массу вещества, нам ничего не стоит рассчитать и молярную массу.
Моль — есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 12 грамм
Таким образом, молярная масса вещества с точностью соответствует относительной молекулярной массе и имеет размерность грамм/моль
Таким образом молярная масса воды равна 18 грамм/моль.
Молярную массу вещества можно определить как отношение массы данной порции вещества к количеству вещества в этой порции
Отличительные особенности
В отношении других калькуляторов, рассчитывающих молярную массу вещества, этот калькулятор обладает следующими особенностями:
— Формула может содержать скобки например
— Формула может содержать коэффициент
Если есть необходимость рассчета массовых долей каждого химическго элемента в формуле то стоит воспользоваться калькулятором Массовая доля вещества онлайн
Интересные факты
Молярные массы каких химических элементов не округляются?
Логично, предположить если вы прочитали, откуда появляется понятие «относительная масса», что «не округленная» масса будет у одного элемента — углерода. Будут ли встречаться другие химические элементы с «не округленными» массами? Сомневаюсь.
синтаксис
molar формула[!]
где формула — произвольная формула химического вещества.
Внимание! Химические элементы в формуле должны быть указаны так, как в таблице Менделеева.
простой пример покажет какая цена ошибки не соблюдать регистр (прописные или строчные символы) букв
Если напишем CO — то это углерод и кислород, а если напишем Co — то это кобальт.
В любую часть формулы, можно вставить служебный символ(восклицательный знак).
Что же он нам дает?
Он все параметры огругляет до того уровня точности, который используется в школьной программе. Это очень удобно именно для тех, кто решает школьные задачи.
Например молярная масса воды в школьных учебниках равна 18, а если учитывать более точные алгоритмы, то получаем что молярная масса равна 18.01528. Разница небольшая, но если делать расчет например массовой доли химического вещества, получается небольшое, но очень неприятное расхождение в выходных параметрах, которое может ввести в заблуждение неопытных пользователей калькулятора.
Примеры
Рассчитать молярную и молекулярную массу вещества
пишем запрос molar NaMgU3O24C18h37
получаем ответ
| Молярная масса вещества (Грамм/Моль) |
|
1388.80945 |
| Формула химического вещества |
Если же в входных параметрах написать символ- восклицательный знак, то получим такой ответ
Молярная масса вещества равна 1389
Рассчитать молярную массу
Пишем K4[Fe(CN)6]
| Молярная масса вещества (Грамм/Моль) |
|
368.3464 |
| Формула химического вещества |
Узнаем молекулярную, а также молярную массу
В результате запроc выглядит так molar CuSO4*5h3O
И ответ выглядит так
| Молярная масса вещества (Грамм/Моль) |
|
249.68 |
| Формула химического вещества |
Как уже было сказано в статье выше, молярная масса и молекулярная масса вещества равны друг другу и отличаются лишь тем, что молекулярная масса безразмерная величина, в отличии от молярной массы (грамм/моль)
Удачных Вам расчетов!
- Окислы химических веществ >>
abakbot.ru
Молярная масса вещества онлайн
| Молярная масса вещества (Грамм/Моль) |
| Формула химического вещества |
Введение в химические формулы
Не секрет , что химические знаки позволяют изобразить состав сложного вещества в виде формул.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Формулы различают молекулярные, структурные, электронные и другие.
Молекулярные формулы (h4P04, Fe203, А1(ОН)3, Na2S04, 02 и т.д.) показывают качественный (т.е. из каких элементов состоит вещество) и количественный (т.е. сколько атомов каждого элемента имеются в веществе) состав.
Структурные формулы показывают порядок соединения атомов в молекуле, соединяя атомы черточками (одна черточка — одна химическая связь между двумя атомами в молекуле).
Относительная атомная и молекуряная масса
Относительная атомная масса вещестав или элемента — это безразмерная величина. Почему безразмерная, ведь масса должна иметь размерность?
Причина в том что атомная масса вещества в кг очень мала и выражается порядком 10 в минус 27 степени. Что бы в расчетах не учитывать этот показатель, массу каждого элемента привели к отношению 1/12 массы изотопа углерода. По этой причине относительная атомная масса углерода и составляет 12 единиц.
Современные значения относительных атомных масс приведены в периодической системе элементов Д.И.Менделеева. Для большинства элементов указаны
среднеарифметические значения атомных масс природной смеси изотопов этих элементов.
Например, относительная масса водорода равна 1, а кислорода 16.
Относительная молекулярная масса простых и сложных веществ численно равна сумме относительных атомных масс атомов, входящих в состав молекулы.
Например, относительная молекулярная масса воды , состоящей из двух атомов водорода и одного атома кислорода, равна
1*2+16 =18
По химической формуле можно вычислить как химический состав, так и молекулярную массу.
Определяемый по химическим формулам количественный состав имеет огромное значение для многочисленных расчетов, которые производятся по химическому составу.
Вычисление относительной молекулярной массы вещества по химической формуле производится путем сложения произведений относительных атомных масс элементов на соответствующие индексы в химической формуле.
Как рассчитывается молекулярная масса вещества мы рассмотрели чуть выше.
И именно эту задачу автоматизирует наш химический калькулятор.
Зная молекулярную массу вещества, нам ничего не стоит рассчитать и молярную массу.
Моль — есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 12 грамм
Таким образом, молярная масса вещества с точностью соответствует относительной молекулярной массе и имеет размерность грамм/моль
Таким образом молярная масса воды равна 18 грамм/моль.
Молярную массу вещества можно определить как отношение массы данной порции вещества к количеству вещества в этой порции
Отличительные особенности
В отношении других калькуляторов, рассчитывающих молярную массу вещества, этот калькулятор обладает следующими особенностями:
— Формула может содержать скобки например
— Формула может содержать коэффициент
Если есть необходимость рассчета массовых долей каждого химическго элемента в формуле то стоит воспользоваться калькулятором Массовая доля вещества онлайн
Интересные факты
Молярные массы каких химических элементов не округляются?
Логично, предположить если вы прочитали, откуда появляется понятие «относительная масса», что «не округленная» масса будет у одного элемента — углерода. Будут ли встречаться другие химические элементы с «не округленными» массами? Сомневаюсь.
синтаксис
molar формула[!]
где формула — произвольная формула химического вещества.
Внимание! Химические элементы в формуле должны быть указаны так, как в таблице Менделеева.
простой пример покажет какая цена ошибки не соблюдать регистр (прописные или строчные символы) букв
Если напишем CO — то это углерод и кислород, а если напишем Co — то это кобальт.
В любую часть формулы, можно вставить служебный символ(восклицательный знак).
Что же он нам дает?
Он все параметры огругляет до того уровня точности, который используется в школьной программе. Это очень удобно именно для тех, кто решает школьные задачи.
Например молярная масса воды в школьных учебниках равна 18, а если учитывать более точные алгоритмы, то получаем что молярная масса равна 18.01528. Разница небольшая, но если делать расчет например массовой доли химического вещества, получается небольшое, но очень неприятное расхождение в выходных параметрах, которое может ввести в заблуждение неопытных пользователей калькулятора.
Примеры
Рассчитать молярную и молекулярную массу вещества
пишем запрос molar NaMgU3O24C18h37
получаем ответ
| Молярная масса вещества (Грамм/Моль) |
|
1388.80945 |
| Формула химического вещества |
Если же в входных параметрах написать символ- восклицательный знак, то получим такой ответ
Молярная масса вещества равна 1389
Рассчитать молярную массу
Пишем K4[Fe(CN)6]
| Молярная масса вещества (Грамм/Моль) |
|
368.3464 |
| Формула химического вещества |
Узнаем молекулярную, а также молярную массу
В результате запроc выглядит так molar CuSO4*5h3O
И ответ выглядит так
| Молярная масса вещества (Грамм/Моль) |
|
249.68 |
| Формула химического вещества |
Как уже было сказано в статье выше, молярная масса и молекулярная масса вещества равны друг другу и отличаются лишь тем, что молекулярная масса безразмерная величина, в отличии от молярной массы (грамм/моль)
Удачных Вам расчетов!
abakbot.ru
Молярная масса, расчет по формуле вещества
Молярная масса вещества складывает из суммы молярных масс атомов, входящих в химическую формулу. Атомные молярные массы — это константы, значения которых можно узнать в химическом справочнике (иногда атомные массы пишут прямо в периодической таблице элементов).
К примеру, молярная масса водорода (химическая формула молекулы водорода — H2) это удвоенная атомарная молярная масса элемента водород (H) :
1.0079 * 2 = 2.0158 г/моль
Для упрощения расчетов, особенно в школе, используют округленные значения молярных масс. Но компьютеру не сложно посчитать без округления, а также найти нужные молярные массы атомов в табличке за вас.
Калькулятор молярной массы
Все что нужно знать — это химическую формулу вещества.
Калькулятор распознаёт химические элементы в формуле и считает их общую массу. Но могут быть неоднозначности, к примеру формула h3CO3 (угольная кислота), написанная без учета регистра — h3co3 — будет воспринята калькулятором как h3Co3, т.е как некий гидрид Кобальта.
Чтобы помочь калькулятору распознать элементы в формуле, нужно учитывать регистр. Но на мобильном телефоне не удобно постоянно менять регистр ввода. В этом случае разделяйте хим. элементы пробелом. Увидев пробелы, программа сообразит, что это отдельные элементы.
Примеры формул, которые понимает калькулятор:
C8h20N4O2 (кофеин), (Nh5)2SO4 (сульфат аммония), 4Na2CO3 * 1.5 h3O2 (перкарбонат натрия), h3 s o 4 (серная кислота)
ZnS (Сфалерит, цинковая обманка)
Молярная масса 97.456, г/моль
| # | Элемент | Масса, г/моль | N | Σ, г/моль |
|---|---|---|---|---|
| Zn | Цинк | 65.39 | 1 | 65.39 |
| S | Сера | 32.066 | 1 | 32.066 |
Уголок химика
Написать комментарийДанная запись опубликована в 21.12.2016 17:52 и размещена в На первой полосе. Вы можете перейти в конец страницы и оставить ваш комментарий.
shra.ru
8. Количество и молярная масса вещества
В химических экспериментах и технологических процессах имеют дело не с отдельными атомами и молекулами, а с той или иной массой (или объемом) вещества, в которой содержится огромное число атомов и молекул. Для проведения расчетов с такими массами введено понятие о количестве вещества. Количество вещества определяется числом содержащихся в нем атомов или молекул.
Количество вещества обозначается символом n (читается: эн) Единицей количества вещества является моль.
Один моль – это такое количество вещества, в котором содержится столько молекул, атомов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Число структурных единиц, составляющих один моль вещества, известно: 6,02∙1023. Это число называется постоянной Авогадро (или числом Авогадро) и является одной из фундаментальных постоянных величин в химии и физике.
Примечание. Строго говоря, числом Авогадро – это число 6,02∙1023, а постоянная Авогадро – это то же число с указанием единицы измерения: 6,02∙1023 моль–1.
Масса одного моля вещества называется молярной массой; её обозначение (символ) – М, единица измерения – г/моль. Для веществ с атомной структурой (благородные газы, металлы, бор, углерод, кремний) молярная масса равна относительной атомной массе, выраженной в граммах, например: M(Fe) = 55,85 г/моль » 56 г/моль. Для веществ с молекулярной структурой молярная масса равна относительной молекулярной массе, выраженной в граммах, например: M(H2SO4) » 98 г/моль. Для веществ с ионной структурой молярная масса рассчитывается для формульной единицы вещества, например: M(CaCO3) » 100 г/моль.
Термин моль – это полное название единицы измерения количества вещества, и в то же время её сокращенное обозначение; в других единицах измерения такого не бывает: сравните, например, килограмм – кг, метр – м, секунда – с. Поэтому слово моль при написании после числа и в заголовках таблиц не склоняется, но при чтении текста его следует склонять, иначе нарушаются правила грамматики. Например, написан текст: в химической реакции 500 г NaOH провзаимодействовало с 1 кг H2SO4. Читается: в химической реакции пятьсот граммов гидроксида натрия провзаимодействовало с одним килограммом серной кислоты. Написан текст: в химической реакции 2 моль KOH провзаимодействовало с 3 моль HNO3.Читается: в химической реакции два моля гидроксида калия провзаимодействовало с тремя молями азотной кислоты.
Часто в химических текстах перед указанием числа молей пишутся слова «количество вещества», например: «в реакции участвовало количество вещества аммиака 5 моль». Такая фраза для русского языка непривычная. Для сравнения вспомним, что когда речь идет не о количестве, а о массе или объеме, то в этих случаях говорят просто и естественно: «в реакции участвовало 25 г хлорида бария»; нигде нет неестественных для русского языка фраз типа: «в реакции участвовала масса хлорида бария 20 г». Но термин «количество» применяется не только в том смысле, который он имеет в химии, но шире, например количество тепла, электричества, денег, людей и т.д. Именно по этой причине принято говорить «в реакции участвовало количество вещества аммиака 5 моль».
Понятие моль распространяется на любые формульные и структурные единицы: nFe – количество атомов железа, n(H2O) – количество молекул воды, nNaCl – количество формульных единиц хлорида натрия, n(Na+) – количество катионов натрия, nOH –количество групп OH, ne – количество электронов. В текстах формульная или структурная единица указана и разночтений не бывает. В устной речи молекулы и формульные единицы специально не указываются, а все остальные структурные единицы следует указывать. Например, если имеют в виду молекулярный водород Н2, то говорят: количество водорода. Это следует понимать так, что все знают о том, что естественное состояние водорода, азота, кислорода, галогенов – это двухатомные молекулы, а не атомы. К сожалению, это знают не все. Поэтому приходится говорить: количество молекулярного водорода, хотя при обычных условиях существование атомарного водорода невозможно.
Количество вещества (n), масса (m) и молярная масса (M) связанны между собой соотношениями:
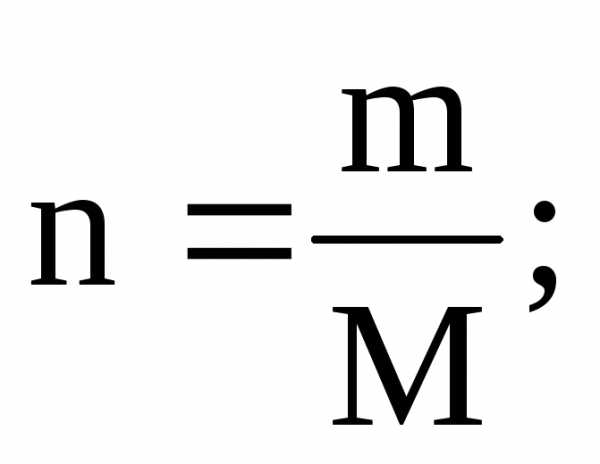 m
= n·M;
m
= n·M; 
Пример . Какое количество воды содержится в 0,9 л этого вещества?
Решение. Плотность воды равна единице (1 кг/л), следовательно, масса 0,9 л воды равна 0,9 кг или 900 г. Молярная масса Н2О 18 г/моль. Искомая величина равна 900:18, т.е. 50 моль.
Пример . Вычислитt массу 25 моль гидроксида калия.
Решение. Молярная масса КОН равна 56 г/моль, поэтому масса 25 моль этого вещества составляют 25∙56, т.е. 50 моль.
Пример. Массе 5,39 г соответствует 0,05 моль неизвестного металла. Какой это металл?
Решение. Вычисляем молярную массу неизвестного металла, она равна 5,39:0,05, т.е. 107,8 г/моль. Это означает, что неизвестный металл (находим его по атомной массе в Периодической системе) – серебро.
studfiles.net
