h3SO4, степень окисления серы и др элементов
Общие сведения о серной кислоте и степени окисления в h3SO4
Брутто-формула – H2SO4. Молярная масса – 98 г/моль.В твердом и жидком состоянии молекулы H2SO4 связаны водородными связями. Жидкий H2SO4 – ионизирующий растворитель.
Серная кислота смешивается с водой в любых соотношениях. Является сильным электролитом, т.е. в водном растворе практически полностью диссоциирует на ионы (строение сульфат иона представлено на рис. 1). В ОВР проявляет себя в роли окислителя.
Рис. 1. Строение сульфат-иона.
h3SO4 , степени окисления элементов в ней
Чтобы определить степени окисления элементов, входящих в состав серной кислоты, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степени окисления водорода и кислорода в составе неорганических кислот всегда равны (+1) и (-2) соответственно. Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + х + 4×(-2) = 0;
2 + х — 8 = 0;
x — 6 = 0;
x = +6.
Значит степень окисления серы в серной кислоте равна (+6):
H+12S+6O-24.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| 8 | Найти число нейтронов | Tc | |
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| 37 | Найти число нейтронов | Na | |
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | ||
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
SO4, степень окисления серы и кислорода в сульфат-ионе
Общие сведения о сульфат-ионе и степени окисления в SO4
Поэтому соли серной кислоты носят название – сульфаты, например, Na2SO4– сульфат натрия, CaSO4– сульфат кальция, K2SO4 – сульфат калия и т.д.
Сульфат ион имеет строение, представленное на рис. 1.
Рис. 1. Строение сульфат-иона.
Существуют реактивы, добавление которых позволяет обнаружить сульфат-ион в растворе (качественная реакция на сульфат-ион). Это растворимые соли бария. В результате наличия сульфат-ионов в растворе будет наблюдаться выпадение кристаллического осадка белого цвета нерастворимого в азотной кислоте. Например:
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2NaNO3;
2Na+ + SO42- + Ba2+ + 2NO3— = BaSO4↓ + 2Na+ + 2NO3—;
SO42- + Ba2+ = BaSO4↓.
SO4, степени окисления элементов в нем
Сульфат-ион – это кислотный остаток серной кислоты, формула которой H2SO4. В её составе имеется два атома водорода, следовательно, степень окисления сульфат-иона равна (-2). Для нахождения степени окисления серы примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4× (-2) = -2;
x — 8 = -2;
x = +6.
Степень окисления серы в сульфат-ионе равна (+6).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Степень окисления | Учись легко
Степень окисления
20.11.2010 Автор: Т U
Степень окисления – условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит из ионов, но в целом электронейтральна.
I. Определение степени окисления:
- Степень окисления простых веществ равна нулю:
Na0, Сa0, H20
- Степень окисления металлов главных подгрупп положительна и равна номеру группы:
Na+, Mg+2, Al+3
- Степень окисления кислорода равна -2
O-2
(некоторые исключения: H2O2-1, Na2O2-1, BaO2-1)
- Степень окисления водорода равна +1
Н+
(исключения соединения с металлами: NaH—, CaH2— )
- Алгебраическая сумма степеней окисления в молекуле равна нулю
Na+Cl—, Ca+2Cl2—
II. Алгоритм определения степени окисления химического элемента в соединениях:
Определим степень окисления каждого элемента в серной кислоте:
1. Степень окисления водорода равна +1
H+2SO4
2. Степень окисления кислорода равна -2
H+2SO4-2
3. Мы знаем, что алгебраическая сумма степеней окисления должна быть равна нулю. Начинаем вычислять степень окисления серы:
Сумма степеней окисления для четырёх атомов кислорода (а в серной кислоте их 4) равна -8 (-2х4=-8)
Для двух атомов водорода: +1х2=+2
-8(для кислорода)+2(для водорода)=-6
Чтобы в итоге молекула была нейтральна степень окисления серы должна быть равна +6
(-6+6=0)
H+2S+6O4-2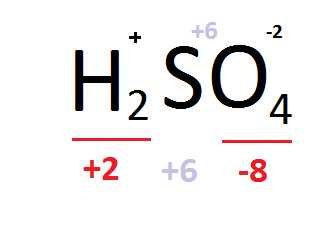
Понравилось это:
Нравится Загрузка…
Похожее
Опубликовано в 9 класс | 2 комментария
4schoolchild.wordpress.com
научите определять степень окисления! пожалуйста.
Алгоритм «Определение степени окисления элементов по химической формуле» Задание: Определите степени окисления элементов в серной кислоте (h3SO4) 1.Написать формулу серной кислоты h3SO4 2.По периодической таблице определить степень окисления элемента, стоящего слева. Определение производить согласно правила: элемент, стоящий слева отдает электроны, его степень окисления положительна и численно равна номеру группы элемента. Так слева в формуле расположен водород это элемент первой группы периодической системы, следовательно его степень окисления равна +1 (h3+1SO4)[1][2] 3.По периодической таблице определить степень окисления элемента, стоящего справа. Определение производить согласно правила: элемент, стоящий справа принимает электроны, его степень окисления отрицательна и численно равна номеру группы, в которой находится элемент минус восемь ( №периода — 8).[2][3] Так справа в формуле расположен кислород, это элемент шестого периода, следовательно его степень окисления равна (6-8=-2). h3+1SO4-2 .4.Определить степень окисления третьего элемента согласно правила: сумма степеней окисления всех атомов, образующих частицу равна заряду частицы — для нейтральной молекулы — это 0. С этой целью составим математическое уравнение, включив в него степени окисления всех атомов молекулы и приняв за х степень окисления серы. 2(+1) + х + 4(-2) = 0 5.Решить уравнение, определив степень окисления серы. Х=+6 6.Проставить степени окисления элементов в химической формуле h3+1S+6O4-2 Степень окисления не всегда совпадает с валентностью.
если не путаю, она обычно совпадает с валентностью что ли. но ты почитай учебник.
ребята, вы ващи тупые, я тоже не знаю
touch.otvet.mail.ru
