Методика решения задач на определение молярной концентрации.
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора?
Какой объем 38 % — го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей h3SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора h3SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М Nh5CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл.
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % — го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % — го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С — ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С — ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С — ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон — ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 — ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 — ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р — ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С — ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С — ? 2. m в-ва = 1090 г ∙ 0,1 = 109 г
3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра — ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 — ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 — ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра — 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
V р-ра 1 — ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 — ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра — ?
5. 15,7 % 10 м.ч
10 %
0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 — ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω — ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 — ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
Ответ: 3,65 М
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
4. С = 6 моль / 1 л = 6 М
Ответ: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 — ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
kopilkaurokov.ru
Молярность | Задача 1 — 3
Молярность (molarity) — способ выражения концентрации, показывающей количество растворенного вещества (п, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
1. Определим количество вещества серной кислоты:
2. Определим объем раствора:
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.
Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
1. Определим объем 700 г раствора
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 .40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
1 . Определяем количество вещества NаС1:
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН2О) = 3 + 200 = 203 г.
3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
Определим молярную концентрацию NаС1 в растворе:
Ответ: 0,24моль/л.
Комментарии:
1 Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2 Справочное значение плотности данного раствора равно 1,009 г/мл.
buzani.ru
Разработка урока на тему «Решение расчетных задач. Вычисление процентной и молярной концентрации растворов.»
Дата: Класс: 10 урок 24 | |||||
Тема: Решение расчетных задач. Вычисление процентной и молярной концентрации растворов. | |||||
Цель урока: развитие знаний учащихся о решение расчетных задач на вычисление процентной и молярной концентрации растворов. Образовательные задачи: учить решать расчетные задачи с использованием понятия «растворы», «концентрация растворов», применять полученные знания на практике, закрепить знания о физических характеристиках растворов и растворенных веществ, умения рассчитывать молярные массы веществ, проверить способность к самостоятельной деятельности. Развивающие задачи: развивать логическое мышление, наблюдательность, способность к анализу и синтезу, коммуникативные навыки работы в группе, формировать навыки самоконтроля. Стимулировать познавательную деятельность | |||||
Деятельность учителя | Деятельность обучающихся | наглядности | |||
3 мин. | I. Организационный момент. Приветствует учеников. Для создания психологической атмосферы проводит игру «Мне в тебе нравится…». | Ученики делятся на группы. Осмысливают поставленную цель. | мяч | ||
10 мин. | II. Проверка пройденного материала. По методу «Поп-корн» осуществляет проверку домашней работы. Опрос в виде интеллектуального тренинга. | растворителем | |||
Какие признаки растворов вы знаете? | Однородность и прозрачность | ||||
Что образует вода со многими веществами? | Растворы | ||||
Гомогенная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия | растворы | ||||
Что происходит при упаривании растворов? | Кристаллизация | ||||
Какое понятие существует в химии между растворимым веществом и растворителем? | Концентрация растворов. | ||||
раствор – это то же самое, что гомогенная смесь.
растворителем называют жидкость, растворяющую вещество.
«Подобное растворяется в подобном»
На растворимость влияют площадь поверхности растворяемого вещества, давление и температура.
Разбавлением называют процесс добавления дополнительного количества растворителя в раствор, чтобы уменьшить его концентрацию
Демонстрируют свои знания, умения по домашней работе.
Семантическая карта
20 мин.
III. Актуализация знаний
Постановка цели урока. Мотивация изучения материала. Контролирует выполнение записей учащимися. Предлагает ученикам составить «Синквейн».
Концентрация – показывает, сколько вещества содержится в данном растворе.
Виды концентрации растворов.
Ученик решает задачу у доски.
Условие: 30 г нитрата калия добавили в 170 г воды. Определите процентную концентрацию полученного раствора.
Задача №1.
В растворе объемом 700 мл содержится хлорид
магния массой 9,5 г. Определите молярную концентрацию растворенного вещества.
Дано: Решение:
V = 700млили 0,7л М (МgСl2 ) = 24 + 35,5*2 =
m (МgСl2 ) = 9,5 г 95г/моль
m 9,5г
См =- —— = ———- = 0, 143 моль/л, или 0,143М
М*V 95г/моль*0,7
Ответ: См (МgСl2 ) = 0, 143 моль/л, или 0,143М
«Собрать колбу»
Задача №1. 10 г нитрата калия добавили в 80 г воды. Определите процентную концентрацию полученного раствора. (11%)
Задача №2. Рассчитайте массу сахара и обьем воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%. (60г, 540г)
Задача №3. Вычислите массу раствора NaCl с массовой долей NaCl 3% и плотностью 1,02г/мл, если обьем раствора 600мл. (1836)
«Восстановить последовательность»
Задача №1. Вычислите молярную концентрацию азотной кислоты, если в растворе объёмом 2л содержится 12,6 г вещества. (0,1М)
Задача №2. Определите массу растворенного вещества, содержащегося в растворе объемом 500 мл с молярной концентрацией КОН 0,1 моль/л. (2800г)
Задача №3. Определите массу растворенного вещества, содержащегося в растворе объемом 200мл с концентрацией NН4 NО3 0,025 моль/л. (400г)
Связь между разными способами выражения концентрации.
Для первой группы:
Вывести формулу, связывающую растворимость вещества с массовой долей.
Для второй группы:
Вывести формулу, связывающую молярную массу с массовой долей.
10 мин.
IV.Итог урока.
Организует систематизацию и обобщение совместных достижений. Организует индивидуальную работу по личным достижениям.
Задачи на приготовление растворов
Какую массу сульфата калия и воды надо взять для приготовления 300г.20% раствора?
Сколько граммов воды содержится в 200г.40%-ного раствора поваренной соли?
Проводит рефлексию.
— Понравился ли вам урок?
— Что было трудным для вас?
— Что вам больше понравилось?
Оценивают работу своих одноклассников.
На стикерах записывают свое мнение по поводу урока.
сфетофор
стикеры
2 мин.
Объясняет особенности выполнения домашней работы.
Решить задачи:
1. В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.
2. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
Записывают домашнюю работу в дневниках.
Карточка 1
растворителем
Какие признаки растворов вы знаете?
Однородность и прозрачность
Что образует вода со многими веществами?
Растворы
Гомогенная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
растворы
Что происходит при упаривании растворов?
Кристаллизация
Какое понятие существует в химии между растворимым веществом и растворителем?
Концентрация растворов.
Карточка 2
«Собрать колбу»
Задача №1. 10 г нитрата калия добавили в 80 г воды. Определите процентную концентрацию полученного раствора. (11%)
Задача №2. Рассчитайте массу сахара и обьем воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%. (60г, 540г)
Задача №3. Вычислите массу раствора NaCl с массовой долей NaCl 3% и плотностью 1,02г/мл, если обьем раствора 600мл. (1836)
«Восстановить последовательность»
Задача №1. Вычислите молярную концентрацию азотной кислоты, если в растворе объёмом 2л содержится 12,6 г вещества. (0,1М)
Задача №2. Определите массу растворенного вещества, содержащегося в растворе объемом 500 мл с молярной концентрацией КОН 0,1 моль/л. (2800г)
Задача №3. Определите массу растворенного вещества, содержащегося в растворе объемом 200мл с концентрацией NН4 NО3 0,025 моль/л. (400г)
Домашнее задание:
Решить задачи:
1. В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.2. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
Домашнее задание:
Решить задачи:
1. В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.2. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
Домашнее задание:
Решить задачи:
1. В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.2. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
Домашнее задание:
Решить задачи:
1. В 400г. Воды растворили11.2 л.сероводорода. Определите процентное содержание сероводорода в полученном растворе.2. В каком объеме воды надо растворить 200г.хлорида железа (Ш) чтобы получить раствор с массовой долей растворенного вещества 15 %.?
infourok.ru
Задачи на концентрации растворов
Для решения задач необходимо знать определения и математические выражения следующих способов выражения концентраций растворов: массовой доли W(%), молярной концентрации С(моль/л), молярной концентрации эквивалента С( (моль/л) и титра t или Т (г/мл), а также связь указанных способов выражения концентрации между собой.
Массовая доля W (процентная концентрация) показывает отношение массы растворенного вещества х, содержащегося в системе, к общей массе этой системы (раствора). W может быть выражена в долях и в процентах:
и (1)
Молярная концентрация С(х) (молярность) – это отношение количества вещества х (в молях), содержащегося в растворе, к объему этого раствора, то есть она показывает, сколько молей растворенного вещества содержится в 1 л раствора.
(моль/л) (2)
Молярная концентрация эквивалента С( (нормальность) показывает отношение количества вещества эквивалента в системе к объему этой системы.
(моль/л), (3)
где или fэкв(х) – фактор эквивалентности – показывает, какая доля частицы вещества x соответствует одному иону водорода в реакциях без изменения степени окисления или одному электрону в ОВР. — безразмерная величина. Например, =1; =1/2; =1/2; =1/3; =1/6; =1; в кисл. среде)=1/5, т.к. в кислой среде Mn+7 восстанавливается до Mn+2, принимая 5 электронов.
Молярная масса эквивалента вещества — – масса одного моля эквивалента вещества.
(г/моль) (4)
Например, ; = =31, г/моль.
Количество вещества эквивалента — количество вещества, в котором частицами являются эквиваленты
= (моль) (5)
Прежнее название молярной концентрации эквивалента – нормальная концентрация или нормальность. Например, раствор с =0,1 моль/л называется децинормальным или 0,1Н.
Титр раствора t или T – это масса вещества, содержащегося в 1 мл раствора. Единица измерения – г/мл.
(г/мл) (6)
Из основных формул можно вывести и вспомогательные. Из формул (2) и (3) выражают массу (в г):
(г) (7)
и (г) (8)
Связь между молярной концентрацией и массовой долей:
(моль/л) (9)
Вывод формулы (9):
поскольку
из (1), а (г/мл)
Связь между молярной концентрацией эквивалента и массовой долей:
(моль/л) (10)
Вывод формулы (10) аналогичен выводу формулы (9).
Связь между молярной концентрацией и титром:
(г/мл) (11)
Вывод формулы (11):
Связь между молярной концентрацией эквивалента и титром:
(г/мл) (12)
Вывод формулы аналогичен выводу формулы (11).
Связь между титром и массовой долей:
(г/мл) (13)
Вывод формулы (13):
Связь между молярной концентрацией и молярной концентрацией эквивалента
(моль/л) (14)
Отсюда (моль/л) (15)
Приравняем правые части формул (7) и (8)
Вместо подставляем ее выражение из (4), т.е. . После сокращения V и М в левой и правой частях уравнения получим формулу (14).
Решение задач
Пример 1. Какой объем раствора H3PO4 с W=30% и r=1,25 г/мл потребуется для приготовления 2 л раствора с молярной концентрацией 0,2 моль/л?
| Дано: W%=30% r=1,25 г/мл V=2 л С(H3PO4) = 0,2 моль/л | Решение: 1) m(H3PO4) = C(моль/л)×V(л)×М(г/моль) = = 0,2×2×98 = 39,2 г 2) m(р-ра) = = = = 130,7 г 3) V(р-ра) = = = 104,56 мл Ответ: 104,56 мл |
| V30% р-ра = ? |
Пример 2. Сколько граммов Na2CO3 нужно взять для приготовления 0,5 л раствора с массовой долей 12% и плотностью 1,1 г/см3?
| Дано: V(р-ра)=0,5л=500 мл r=1,1г/см3 (г/мл) W%=12% | Решение: 1) m(р-ра)=V(p-pa) × r=500мл×1,1 г/мл = 550 г. 2) m(Na2CO3)= =66 г Ответ: 66 г. |
| m(Na2CO3) – ? |
Пример 3. Смешали 100 г раствора NaOH с W%=10% и 0,3 л раствора NaOH c W%=25% (r=1,3 г/мл). Какова массовая доля полученного раствора?
Пример 4. (Разбавление раствора). Сколько воды нужно прибавить к 100 мл 20%-го раствора серной кислоты (r=1,14 г/мл), чтобы получить 3%-ный раствор?
| Дано: W1%=20% W2%=3% V(р-ра)= 100 мл r=1,14 г/мл | Решение: 1) m(р-ра)=V(p-pa) × r= 100мл×1,14 г/мл = 114 г. 2) m(H2SO4)= =22,8 г 3) Так как масса вещества после разбавления остается той же, то m(p-pa)2=m(H2SO4) × 100% / W2% = = =760 г. 4) V(H2O)=m(H2O)=760 г – 114 г = 646 г. Ответ: 646 г или 646 мл. |
| V(H2O) или m(H2O) –? |
Пример 5. (Укрепление раствора). Сколько граммов NaCl нужно добавить к 200 мл 10%-го раствора (r=1,27 г/мл), чтобы получить раствор с массовой долей 15%?
| Дано: V(р-ра)= 100 мл r=1,27 г/мл W1%=10% W2%=15% m(NaCl)доб – ? | Решение: 1) m(р-ра)=V(p-pa) × r= 100мл×1,27 г/мл = 127 г. 2) m(NaCl)= =12,7 г 3) Обозначим m(NaCl)доб за х. Тогда на х г увеличатся массы и вещества и раствора в 15%-ном растворе. 15%= 15×(127+х)=(12,7+х)×100 1905+15х=1270+100х 635=85х; х=7,47 г Ответ: нужно добавить 7,47 г NaCl. |
Пример 6. Сколько граммов щавелевой кислоты H2C2O4×2H2O необходимо взять для приготовления 200 мл децинормального (0,1 моль/л) раствора?
| Дано: C( V(р-ра)= 200 мл = 0,2 л m(H2C2O4×2H2O) – ? | Решение: m(H2C2O4×2H2O)=C( H2C2O4) × V× ×M( H2C2O4×2H2O)=0,1моль/л×0,2л×63г/моль= = 1,26 г. Ответ: 1,26 г H2C2O4×2H2O |
Пример 7. Титр раствора H3PO4 равен 0,004 г/мл. Вычислить W%, C(x), C( ) этого раствора, если r раствора 1,15 г/мл.
| Дано: t = 0,004 г/мл r = 1,15 г/мл W% –? C(x) – ? C( ) – ? | Решение: Воспользуемся формулами связи разных способов выражения концентрации между собой, например, формулами (11), (13) и (15). =0,04 моль/л C( H3PO4) = C(H3PO4)×Z=0,04 моль/л×3= =0,12моль/л Ответ: 0,35%; 0,04 моль/л; 0,12 моль/л. |
Пример 8. Навеска технического карбоната калия массой 0,7 г растворена в 50 мл воды. На реакцию полученного раствора затрачено 48 мл раствора HCl с молярной концентрацией 0,2 моль/л. Определить C(K2CO3), t, m(K2CO3) в растворе и W%(K2CO3) в навеске.
Рекомендуемые страницы:
lektsia.com
Концентрация растворов. Правило креста
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов. Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Показать решение »
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
х г — в 150 г
х =30 г
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
х г — в 100 г
х =15,4
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
х г — в 100 г
х = = 23,1
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Задача 3. Нормальная концентрация раствора KNO3 равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3 и молярную концентрацию раствора KNO3. Плотность раствора принять раной 1 г/мл.
Показать решение »
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
Т.е. 1 н – 101 г
0,2 н. – х г
х = 20,2 г
Теперь вычислим молярную концентрацию
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Т.е. 1 М – 101 г
х – 20,2 г
х = 0,2 моль/л
Таким образом, Сн = См = 0,2 моль/л
Далее находим процентную концентрацию.
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
х = 2,02 г
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Показать решение »
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
х = 235,6 г.
Молярность определим с помощью соотношения:
См = n/V
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Сн = nэ/V
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
nэ = m/ Мэ = 235,6/55,5 = 4,2 моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Показать решение »
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
Найдем Молярную концентрацию эквивалента или нормальность:
M(NaOH) = 23+16+1 = 40 г/моль
Сн = nэ/V
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
nэ = m/ Мэ = 398,4/40 = 9,96 моль
Сн = 9,96/1 = 9,96 н
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
Далее находим процентную концентрацию или массовую долю вещества.
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Показать решение »
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
х1 = 316,2 г
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
х2 = 100,9 г
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
mр-ра (HNO3) = 3162+5045 = 8207 г
Найдем Молярность
См = n/V
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
ω(HNO3) = m (HNO3)/mр-ра = 417,1/8207 = 0,05 или 5 %
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Показать решение »
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10-3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
См = n/V = 0,41/1,5 = 0,274 М
Найдем нормальность:
nэ = m/Мэ = 62,4/76 = 0,82 моль
Сн = nэ/V = 0,82/1,5 = 0,547 н
Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Показать решение »
Решение.
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г — 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Показать решение »
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
V0.5/V0.1 = 0,1/0,3 = 1/3
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для 0,5 М раствора HNO3
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х1 л — 1 л
х1 = 0,25 л
Для 0,1 М раствора HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х2 л — 1 л
х2 = 0,75 л
zadachi-po-khimii.ru
Разработка урока по химии на тему: «Решение задач на молярную концентрацию»
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Класс – 10 (химия)
Проверено _____________
Дата: 25.11.15г.
Урок № 22
Тема урока: Решение расчетных задач на вычисление процентной и молярной концентрации растворов.
Цель: развитие знаний учащихся о решение расчетных задач на вычисление процентной и молярной концентрации растворов.
Образовательные задачи: учить решать расчетные задачи с использованием понятия «растворы», «концентрация растворов», применять полученные знания на практике, закрепить знания о физических характеристиках растворов и растворенных веществ, умения рассчитывать молярные массы веществ, проверить способность к самостоятельной деятельности.
Развивающие задачи: развивать логическое мышление, наблюдательность, способность к анализу и синтезу, коммуникативные навыки работы в группе, формировать навыки самоконтроля. Стимулировать познавательную деятельность
Воспитательные задачи: способствовать формированию ответственного отношения к учению, готовности к мобилизации усилий и безошибочное выполнение заданий, проявить наибольшую активность в их выполнении; воспитывать культуру учебного труда, навыки экономного расходования времени, формировать гуманные качества личности учащихся, совершенствовать навыки общения.
Методы: информативно-прикладной с элементами фронтальной беседы, фронтальная беседа, решение химических задач.
Тип урока : решение задач.
Оборудование: учебник, интерактивная доска, раздаточный материал, таблица Менделеева.
Ход урока.
Организационный момент:
Приветствие.
Целеполагание.
Психологический настрой.
Опрос в виде интеллектуального тренинга.
Чем является вода для многих твердых, жидких и газообразных веществ? растворителем
Какие признаки растворов вы знаете? Однородность и прозрачность
Что образует вода со многими веществами? Растворы
Основные характеристики растворов…..(слайд)
Какое понятие существует в химии между растворимым веществом и растворителем? Концентрация растворов
3.Изучение нового материала и решение задач.
Концентрация – показывает, сколько вещества содержится в данном растворе.
Виды концентрации растворов.

Ученик решает задачу у доски.
Условие: 30 г нитрата калия добавили в 170 г воды. Определите процентную концентрацию полученного раствора.
Задача №1.
В растворе объемом 700 мл содержится хлорид
магния массой 9,5 г. Определите молярную концентрацию растворенного вещества.
Дано: Решение:
V = 700млили 0,7л М (МgСl2 ) = 24 + 35,5*2 =
m (МgСl2 ) = 9,5 г 95г/моль
m 9,5г
См =-—— = ———- = 0, 143 моль/л, или 0,143М
М*V 95г/моль*0,7
Ответ: См (МgСl2 ) = 0, 143 моль/л, или 0,143М
«Собрать колбу»
Задача №1. 10 г нитрата калия добавили в 80 г воды. Определите процентную концентрацию полученного раствора. (11%)
Задача №2. Рассчитайте массу сахара и обьем воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%. (60г, 540г)
Задача №3. Вычислите массу раствора NaCl с массовой долей NaCl 3% и плотностью 1,02г/мл, если обьем раствора 600мл. (1836)
Задача №4. Вычислите массу раствора NaОН с массовой долей NaОН 5% и плотностью 2,01 г/мл, если обьем раствора 800мл. (8040)
Задача №5. В 500 мл воды растворили 15,46г гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе. (3%)
Задача №6. К 80 граммам раствора соли прибавили 40 г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления, она стала равной 18%. (27%)
«Восстановить последовательность»
Задача №1. Вычислите молярную концентрацию азотной кислоты, если в растворе объёмом 2л содержится 12,6 г вещества. (0,1М)
Задача №2. Определите массу растворенного вещества, содержащегося в растворе объемом 500 мл с молярной концентрацией КОН 0,1 моль/л. (2800г)
Задача №3. Определите массу растворенного вещества, содержащегося в растворе объемом 200мл с концентрацией NН4 NО3 0,025 моль/л. (400г)
Задача №4. Вычислите молярную концентрацию гидроксида натрия, если в растворе объёмом 8,6л содержится 18,5 г вещества. (0,05 М)
Задача №5. Определите массу растворенного вещества, содержащегося в растворе объемом 300 мл с молярной концентрацией NН4Сl 0,01 моль/л. (160,5 г)
Рефлексия.
1.Какова цель нашего урока?
2.Достигли ли мы цели?
3.Что представляло наибольшую трудность?
4. На уроке я работал…
5.Своей работой на уроке я…
6.Урок для меня показался…
7. Материал урока мне был…
8. Мое настроение…
Выводы . Оценивание.
Домашнее задание: Решение задач на карточках.
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6.Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6.Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6.Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
kopilkaurokov.ru
В помощь учащимся. Решаем задачи «Способы выражения концентрации раствора».
Процентная концентрация раствора. Процентной концентрацией раствора (С) называется массовая доля растворённого вещества в растворе (W), выраженная в %:С% = W% (растворённого вещества) = (m растворённого вещества• 100%) /m раствора
1. Процентная концентрация показывает, сколько единиц массы (г, кг) растворённого вещества содержится в каждых 100 единицах массы (г, кг) раствора
2. При смешивании двух различных растворов, массовую долю растворённого вещества во вновь полученном растворе определяют по правилу смешения
m1/m2 = (W3-W2)/(W1-W3)Молярная концентрация раствора. Молярную концентрацию (Cm) растворов определяют по формуле:
Cm = υрастворённого вещества/ Vраствора
где ν = m/M — количество вещества
(здесь М — молярная масса вещества), V – объём
Cm измеряют в моль/л или моль/м3 (в системе СИ).
Молярная концентрация показывает количество растворённого вещества (моль), содержащегося в 1л раствора.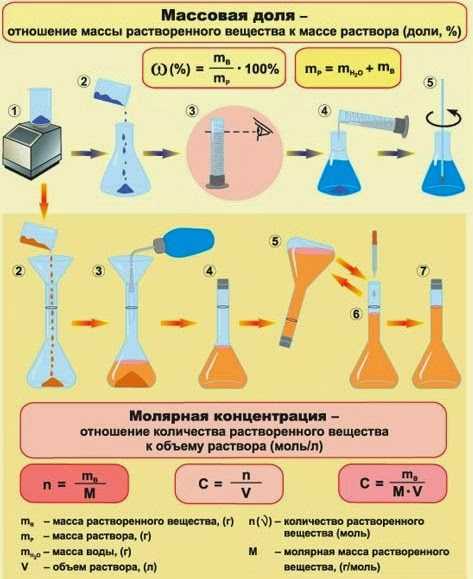 Задачи Какую
массу соли и объем воды необходимо
взять для приготовления 50 г 0,5 %-ного
раствора (ответ: 0,25 г, h3O — 49,75 мл)?
Задачи Какую
массу соли и объем воды необходимо
взять для приготовления 50 г 0,5 %-ного
раствора (ответ: 0,25 г, h3O — 49,75 мл)? | m (р-ра) = 50 г w(соли) = 0,005 m (соли) = ? | Решение: m (соли) = 50 г · 0,005 = 0,25 г соли m (h3O) = 50 г — 0,25 г = 49,75 г V (h3O) = 49,75 г ? 1 г/мл = 49,75 Ответ: m (соли) = 0,25 г |
Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
| m (сахара) = 0,5 г w(cах.) = 0,01 (1 %) V(Н2О) = ? | Решение: 1) m (р-ра) В 100 г р-ра – 1 г сахара х — 0,5 г сахара 2) m (h3O) = 50 – 0,5 = 45,5 г 45,5 г 3) V(Н2О) = ———— = 45,5 мл 1 г/мл Ответ: V(Н2О) = 45,5 мл |
| V(Н2О) = 200 мл
w(соли) = 0,03 (3 %) m (соли) = ? | Решение: 1) 3 %-ный раствор – это на 100 г р-ра – 3 г соли и 97 г воды 2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г 3) m (соли) = ? 3 г соли – на 97 г Н2О х — 200 г Н2О 3 х 200 х = ———- = 6,2 г. 97 Ответ: m (соли) = 6,2 г |
m (p. HCl) = 150 г
w(HCl) = 0,2 (20 %)
V(Н2О) = 200 мл
Найти:
w(HCl) = ?
Решение:
m (HCl) = 150 г х 0,2 = 30 г
m (p-ра) = 150 г + 200 г = 350 г
m (h3O) = 200 мл х 1 г/мл = 200 г
30 г
w(HCl) = ———= 0,086 (8,6 %)
350 г
Ответ:w (HCl) = 0,086 (8,6 %).
Определить молярную концентрацию раствора серной кислоты, полученного при смешивании 25 мл 10-молярного раствора серной кислоты и 225 мл воды.
V(p. h3SO4) = 25 мл
C(h3SO4) = 10 м/л
V(h3O) = 225мл
Найти: C(h3SO4) = ?
Решение:
n(h3SO4) — ?
В 1000 мл – 10 моль
в 25 мл – х моль
х = 0,25 моль
V(р-ра) = 225 мл + 25 мл = 250 мл
C(h3SO4) — ?
himoza1977.blogspot.com
