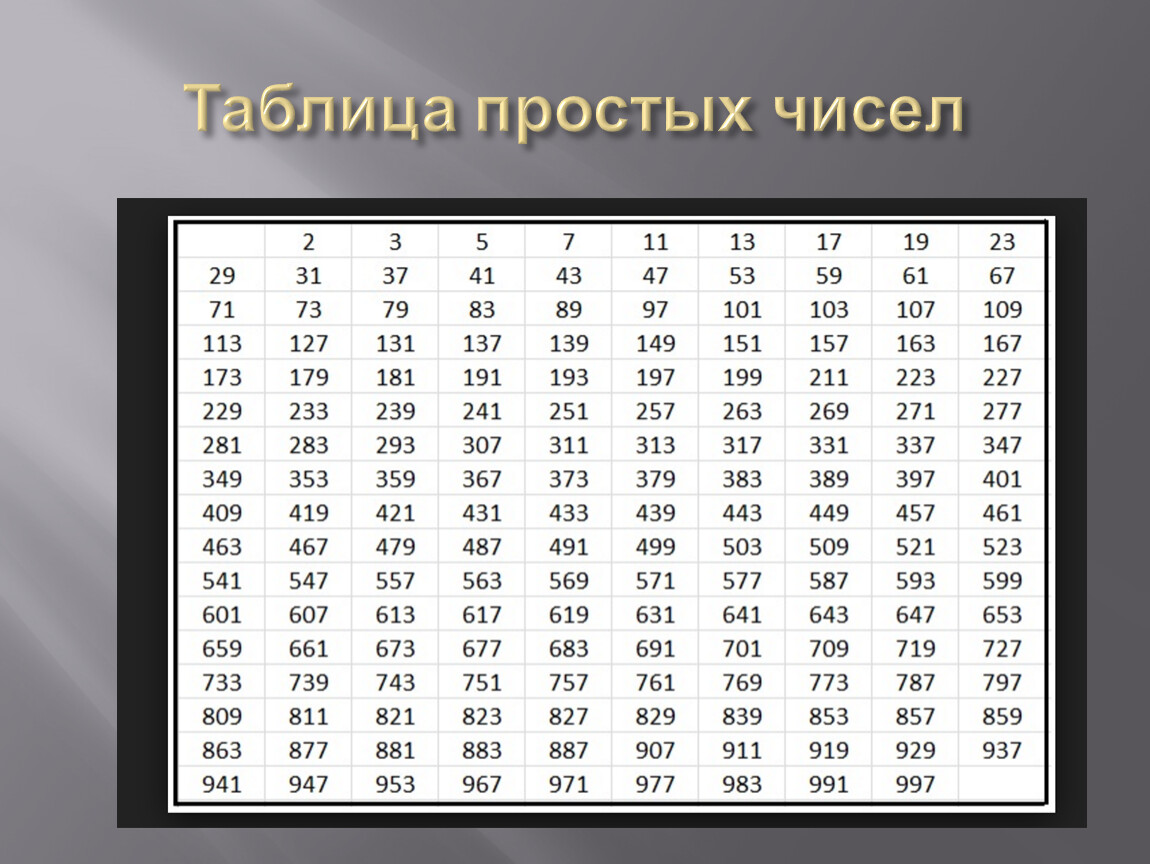
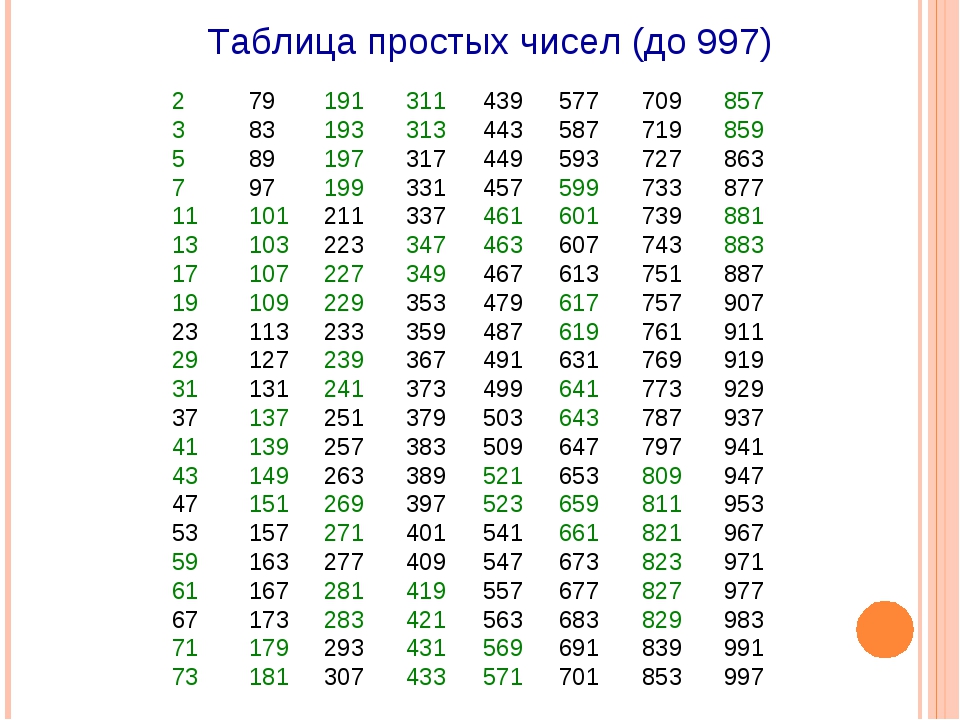
Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
φ°(Mn2+/Mn) = –1,18 В.
Mn + 2h3O = Mn(OH)2 + h3↑.
Mn + 4HNO3 = Mn(NO3)2 + 2NO2↑ + 2h3O.
Э + 7HNO3 = HЭO4 + 7NO2↑ + 3h3O, где Э = Tc, Re.
Соединения марганца(II) MnO, Mn(OH)2 и соли катионного типа
При нагревании:
MnCO3 = MnO + CO2,
MnO + h3O = Mn(OH)2↓,
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4,
2MnSO4 + 2h3O = (MnOH)2SO4 + h3SO4.
Восстановительные свойства:
2Mn(OH)2 + O2 = 2MnO2 + 2h3O,
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7h3O,
3MnSO4 + 2KMnO4 + 2h3O = 5MnO2 + K2SO4 + 2h3SO4.
Mn2O3, слабое основание Mn(OH)3 и соли. Соединения марганца(III) легко диспропорционируют:
Соединения марганца(IV)
MnO2 – чёрно-бурый, Mn(SO4)2, Na2MnO3 (манганит натрия).
Окислительные свойства MnO2:
MnO2 + 4H+ + 2ē = Mn2+ + 2h3O; φ° = 1,23 В.

MnO2 + 4HCl = MnCl2 + Cl2↑ + 2h3O,
MnO2 + 2KBr + h3SO4 = MnSO4 + Br2 + K2SO4 + h3O.
Восстановительные свойства MnO2 (при сплавл.):
Гидролиз:
При сплавлении:
Гидролиз:
Соли марганцовистой кислоты (h3MnO4) – манганаты.
Получение.
При сплавлении:
2KMnO4 + 2KOH + KNO2 = 2K2MnO4 + KNO3 + h3O,
MnSO4 + 4KOH + 2KNO3 = K2MnO4 + 2KNO2 + K2SO4 + 2h3O,
MnSO4 + 2Br2 + 8NaOH = Na2MnO4 + 4NaBr + Na2SO4 + 4h3O.
Диспропорционирование:
Окислительные свойства:
Восстановительные свойства:
Разложение при нагревании (500 °C):
Mn2O7, HMnO4 и её соли перманганаты.
Получение:
2MnSO4 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4 + 7h3O.

2MnSO4 + 5K2S2O8 + 8h3O = 2HMnO4 + 5K2SO4 + 7h3SO4.
2KMnO4 + h3SO4(конц.) = Mn2O7 + K2SO4 + h3O.
Сильные окислители, особенно в кислой среде:
MnO4 — + 2h3O + 3ē = MnO2 + 4OH– ; φ° = +0,60 В;
MnO4 — + ē = MnO4 2- ; φ° = +0,56 В;
MnO4 — + 8H+ + 5 ē = Mn2+ + 4h3O; φ° = +1,51 В.
Окислительные свойства:
2KMnO4 + 6KI + 4h3O = 2MnO2 + 3I2 + 8KOH,
6KMnO4 + KI + 6KOH = 6K2MnO4 + KIO3 + 3h3O,
2KMnO4 + 10KI + 8h3SO4 = 2MnSO4 + 5I2 + 6K2SO4 + 8h3O.
Термическое разложение (выше 250 °C):
Водные растворы неустойчивы:
Разложение Mn2O7:
Mn(OH)2, Mn(OH)3, Mn(OH)4, (h3MnO4), HMnO4.
Основные свойства ослабевают, а кислотные свойства усиливаются в ряду выше.
что, как сбалансировать и часто задаваемые вопросы —
By Лубна Хан
Сульфат марганца (MnSO4) представляет собой кислую ионную соль, а HCl (соляная кислота) представляет собой бесцветную кислоту с резким запахом. Рассмотрим подробно реакцию HCl-MnSO4.
Рассмотрим подробно реакцию HCl-MnSO4.
Соляная кислота реагирует с сульфатом марганца по реакции замещения. MnSO4 — неорганическая гигроскопическая соль, которая поглощает влагу из воздуха с образованием гидратов, а HCl — сильная кислота, которая существует как в жидком, так и в парообразном состоянии.
В этой статье будут рассмотрены энтальпия реакции, продукты, молекулярные силы и другие факторы HCl и MnSO.4 реакция в деталях.
Что является продуктом HCl и MnSO
4MnCl2 (дихлорид марганца) и H2SO4 (Серная кислота) образуются при HCl соединяется с MnSO4.
MnSO4 + HCl → MnCl2 + H2SO4
Какой тип реакции HCl + MnSO?
4HCl+MnSO4 реакция является реакцией двойного замещения.
Как сбалансировать HCl + MnSO
4Реакция MnSO4 с HCl уравновешивается с помощью следующих шагов,
MnSO4 + HCl → MnCl2 + H2SO4
- Первым шагом является определение элементов, участвующих в реакции.
 Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
- Перед соединениями добавляются коэффициенты, чтобы сбалансировать количество элементов с обеих сторон. Коэффициент 2 добавляется перед HCl, чтобы сбалансировать H и Cl. Сбалансированное уравнение будет
- MnSO4 + 2HCl → MnCl2 + H2SO4
HCl + MnSO
4 титрованиеHCl нельзя использовать для титрования MnSO.4 так как оба являются сильными кислотами. Также не наблюдается отчетливого изменения окраски реакции.
HCl + MnSO
4 чистое ионное уравнениеЧистое ионное уравнение для MnSO4 + HCl is
MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
Шаги, необходимые для получения чистого ионного уравнения перечислены ниже,
- Уравнение уравновешивается на первом шаге.
 Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано, - MnSO4 + 2HCl → MnCl2 + H2SO4
- Указаны физические состояния веществ.
- MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
- Расщепление сильных электролиты в их ионы. Все соединения, участвующие в этой реакции, являются сильными электролитами.
- Mn2+(водн.) + SO42-(водн.) + 2H+(водн.) + 2Cl–(водн.) → Mn2+(водн.) + 2Cl–(водн.) + 2H+(водн.) + SO42-(Водно)
- Все ионы являются ионами-спектаторами, поэтому чистой реакции нет. Итак, результирующее ионное уравнение для HCl+MnSO4 is счислимый.

- MnSO4(водн.) + 2HCl (водн.) → MnCl2(вод) + H2SO4(Водно)
HCl + MnSO
4 сопряженные парыСопряженные кислотно-основные пары образуются из HCl-MnSO4.
- HCl как кислота выделяет H+ и формы Cl– как его сопряженное основание.
- SO42- ион, действующий как основание, занимает H+ образуя сопряженную кислоту ( H2SO4).
HCl и MnSO
4 межмолекулярные силы- Диполь-дипольные взаимодействия. а также Лондон-дисперсионные силы присутствуют как межмолекулярные силы между молекулами HCl .
- MnSO4 показывает ион-дипольные взаимодействия так как это ионная соль.
HCl + MnSO
4 энтальпия реакцииMnSO4+HCl энтальпия реакции составляет -12. 6 кДж/моль. Энтальпия рассчитывается с использованием табличных значений,
6 кДж/моль. Энтальпия рассчитывается с использованием табличных значений,
| Соединения | Энтальпия в кДж/моль |
|---|---|
| MnSO4(водный) | 1118.2 |
| HCl (водн.) | 166.8 |
| MnCl2(Водно) | 555.13 |
| H2SO4(Водно) | 909.27 |
∆Нf° = ∆Нf°(продукты) – ∆Hf°(реагенты)
= 1464.4 – 1451.8 = -12.6 кДж/моль
HCl + MnSO
4 буферный растворMnSO4 + HCl не образует буферный раствор поскольку используемая кислота (HCl) является сильной кислотой, и ее комбинация с солью марганца (MnSO4) не будет сопротивляться изменению pH.
HCl + MnSO
4 полная реакцияMnSO4 + HCl является полной реакцией, так как образующиеся продукты достаточно растворимы и в дальнейшую реакцию не вступают.
HCl + MnSO
4 экзотермическая или эндотермическая реакцияMnSO4+HCl реакция экзотермический так как в ходе реакции выделяется большое количество тепла.
HCl + MnSO
4 окислительно-восстановительная реакцияMnSO4 + Реакция HCl не является окислительно-восстановительной реакцией, поскольку степени окисления элементов не не показывать никаких изменений.
HCl + MnSO
4 реакция осажденияHCl+MnSO4 реакция не дает осадка, так что это не реакция осаждения. Полученные продукты полностью растворимы..
HCl + MnSO
4 обратимая или необратимая реакцияMnSO4 + Реакция HCl является необратимой реакцией, поскольку водород, будучи менее реакционноспособным, не может вытеснить Mn из его соли, что делает обратную реакцию менее возможной.
HCl + MnSO
4 реакция смещенияРеакция MnSO4 + HCl представляет собой реакция двойного замещения. Поскольку марганец более реакционноспособен, он вытесняет водород из HCl и образует MnCl.2 а потом Х+ далее сочетается с SO42- ион с образованием H2SO4.
Заключение
MnSO4 имеет широкое применение в животноводстве и сельском хозяйстве. Марганцевая соль (MnCl2) используется в качестве предшественника для синтеза бесчисленного множества марганцевых соединений.
Какова степень окисления Mn в \[\text{KMn}{{\text{O}}_{4}},\text{ }{{\text{K}}_{2}}\text{ Mn}{{\text{O}}_{4}},\text{MnS}{{\text{O}}_{4}},\text{Mn}{{\text{O}}_{ 2}}\text{ и M}{{\text{n}}_{3}}{{\text{O}}_{4}}\] соответственно: A. +7, +6, +2, +4, \[+\dfrac{8}{3}\]В. +4, +6, +2, +4, \[+\dfrac{8}{3}\]С. +7, +6, +2, +3, \[+\dfrac{8}{3}\]D. Ни один из этих
Ответить
Проверено 230. 3k+ просмотров
3k+ просмотров
Полное пошаговое решение :
— Чтобы определить степень окисления атома, мы будем рассматривать его как «X».
— Таким образом, чтобы рассчитать степень окисления марганца в \[\text{KMn}{{\text{O}}_{4}}\], мы будем рассматривать степень окисления марганца как «X».
— Мы знаем, что степень окисления калия и кислорода +1 и -2.
-Итак, уравнение примет вид:
$\begin{align}
& \text{+1 + x — 8 = 0} \\
& \text{x = +7} \\
\end{align}$
-Следовательно, степень окисления Mn равна +7.
— Аналогично, степень окисления Mn в ${{\text{K}}_{2}}\text{Mn}{{\text{O}}_{4}}$ будет
$\begin {align}
& +2\text{ + x — 8 = 0} \\
& \text{x = +6} \\
\end{align}$
-Значит, степень окисления Mn равна +6
-Теперь степень окисления Mn в $\text{MnS}{{\text{O}}_{4}}$ будет
$\begin{align}
& \text{x + 6 — 8 = 0} \\
& \text{x — 2 = 0} \\
& \text{x = +2} \\
\end{align}$
-Мы знаем, что степень окисления серы в сульфат-ионе равна +6, поэтому мы поставили +6 как степень окисления серы.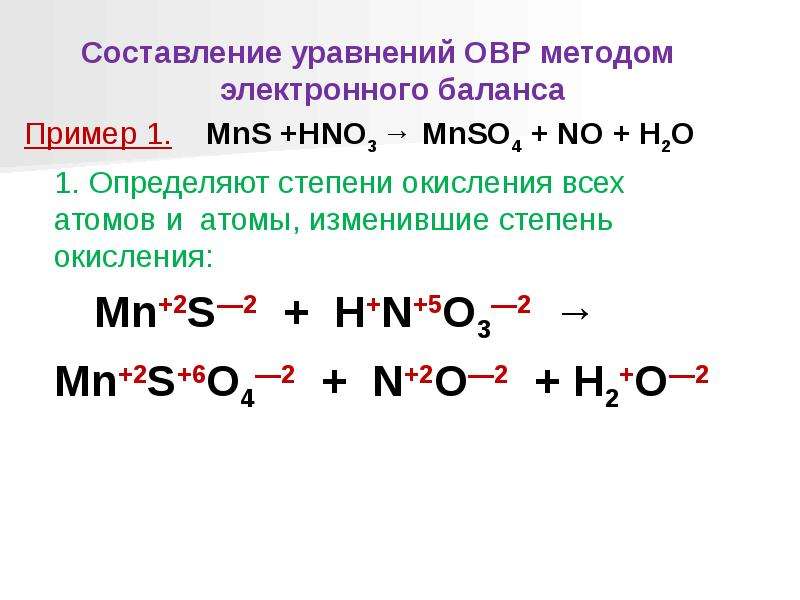
-Значит, степень окисления марганца +2.
— Теперь мы рассчитаем степень окисления Mn в $\text{Mn}{{\text{O}}_{2}}$
$\begin{align}
& \text{x — 4 = 0 } \\
& \text{x = +4} \\
\end{align}$
-Значит, степень окисления Mn равна +2.
-Теперь мы рассчитаем степень окисления Mn в \[\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}\]
\[\begin{align}
& 3\text{x — 8 = 0} \\
& \text{x = +}\dfrac{8}{3} \\
\end{align}\]
-Значит, степень окисления Mn +8/3.
Следовательно, вариант А. является правильным ответом.
Примечание : Перманганат калия относится к категории сильных окислителей. Сера имеет много степеней окисления, таких как -2, 0, +2, +4, +6, и это зависит от связи серы с другими атомами. Как и в сульфате марганца, сера имеет степень окисления +6.
Дата последнего обновления: 13 мая 2023
•
Всего просмотров: 230.3k
•
Просмотров сегодня: 3.92k
Недавно обновленные страницы
900 02 В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_MainЩелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класс химии JEE_Main
В Индии по случаю браков фейерверки 12 класса химии JEE_Main
Щелочные земляные металлы Ba Sr Ca и Mg могут быть расположены химический класс 12 JEE_Main
Что из следующего имеет самый высокий электродный потенциал химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
900 00 T3DB: Сульфат марганца| Информация о записи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 2. 0 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 2009-06-19 21:58:20 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24-12-2014 20:23:11 UTC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер | T3D1131 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификационный номер | Общее название | Сульфат марганца | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Малая молекула | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Сульфат марганца представляет собой сульфат марганца. Это предшественник металлического марганца и многих химических соединений, таких как диоксид марганца. Марганец представляет собой встречающийся в природе металл с символом Mn и атомным номером 25. Он не встречается в природе в чистом виде, но встречается во многих типах горных пород в сочетании с другими веществами, такими как кислород, сера или хлор. Марганец содержится в большинстве продуктов питания, и для поддержания здоровья необходимы небольшие количества, так как ионы марганца действуют как кофакторы для ряда ферментов. (3, 4, 5) (3, 4, 5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тип соединения |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | MnO 4 S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Средняя молекулярная масса | 151,001 г/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Масса моноизотопа | 150,890 г/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 7785-87-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC 9 0109 | сульфат марганца(2+) ион | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Традиционное название | сульфат марганца(2+) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | [Mn++]. [O-]S([O-])(=O)=O [O-]S([O-])(=O)=O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | 90 114 InChI=1S/Mn .h3O4S/c;1-5(2,3)4/h;(h3,1,2,3,4)/q+2;/p-2|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ключ ИнЧИ | ИнЧИКей=SQQMAOCOWKFBNP-UHFFFAOYSA -L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая таксономия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | принадлежит к классу неорганических соединений, известных как сульфаты переходных металлов. Это неорганические соединения, в которых самым большим оксоанионом является сульфат, а самым тяжелым атомом, не входящим в оксоанион, является переходный металл. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Королевство | Неорганические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Смешанные соединения металлов и неметаллов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | 9011 4 Оксоанионные соединения переходных металлов|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Сульфаты переходных металлов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прямые исходные вещества | Сульфаты переходных металлов | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Альтернативные исходные вещества |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические свойства 9 | Статус | Обнаружено и не определено 14
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биофлюиды | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ткани | Нет | Пути | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приложения | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химические роли | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние | Твердое вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | Твердое вещество бледно-красного цвета.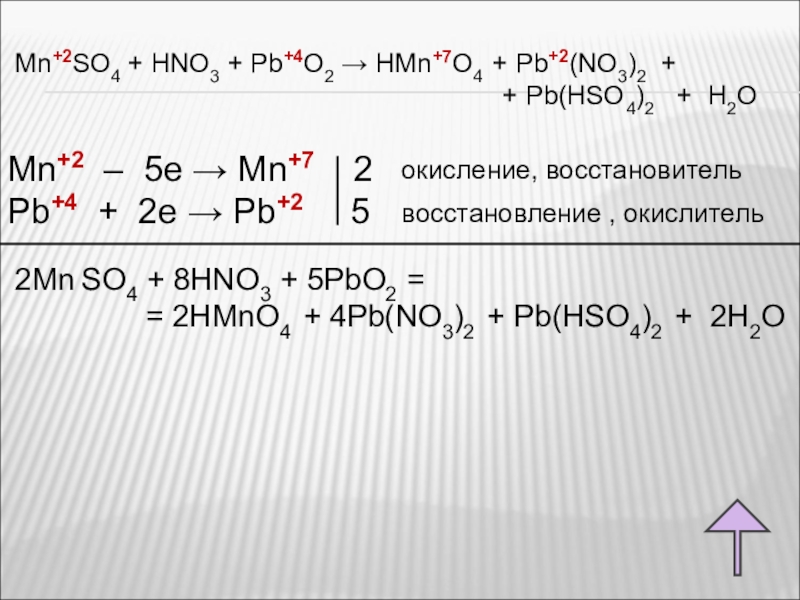 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные свойства |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Профиль токсичности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Путь воздействия | Оральный (3) ; вдыхание (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Механизм токсичности | Марганец является клеточным токсикантом, который может нарушать транспортные системы, активность ферментов и функции рецепторов. Он в первую очередь нацелен на центральную нервную систему, особенно на бледный шар базальных ганглиев. Считается, что ион марганца, Mn(II), усиливает самоокисление или обмен различных внутриклеточных катехоламинов, что приводит к увеличению образования свободных радикалов, активных форм кислорода и других цитотоксических метаболитов, наряду с истощением клеточных механизмов антиоксидантной защиты. что приводит к окислительному повреждению и избирательному разрушению дофаминергических нейронов. Считается, что помимо дофамина марганец воздействует на другие нейротрансмиттеры, такие как ГАМК и глутамат. Чтобы вызвать окислительное повреждение, марганец должен сначала подавить антиоксидантный фермент марганцевую супероксиддисмутазу. Нейротоксичность Mn(II) также связана с его способностью замещать Ca(II) в физиологических условиях. Он может проникать в митохондрии через унипортер кальция и ингибировать митохондриальное окислительное фосфорилирование. Он также может ингибировать отток Ca(II), что может привести к потере целостности митохондриальной мембраны. Он в первую очередь нацелен на центральную нервную систему, особенно на бледный шар базальных ганглиев. Считается, что ион марганца, Mn(II), усиливает самоокисление или обмен различных внутриклеточных катехоламинов, что приводит к увеличению образования свободных радикалов, активных форм кислорода и других цитотоксических метаболитов, наряду с истощением клеточных механизмов антиоксидантной защиты. что приводит к окислительному повреждению и избирательному разрушению дофаминергических нейронов. Считается, что помимо дофамина марганец воздействует на другие нейротрансмиттеры, такие как ГАМК и глутамат. Чтобы вызвать окислительное повреждение, марганец должен сначала подавить антиоксидантный фермент марганцевую супероксиддисмутазу. Нейротоксичность Mn(II) также связана с его способностью замещать Ca(II) в физиологических условиях. Он может проникать в митохондрии через унипортер кальция и ингибировать митохондриальное окислительное фосфорилирование. Он также может ингибировать отток Ca(II), что может привести к потере целостности митохондриальной мембраны. Было показано, что Mn(II) ингибирует активность митохондриальной аконитазы до значительного уровня, изменяя метаболизм аминокислот и гомеостаз клеточного железа. (3) Было показано, что Mn(II) ингибирует активность митохондриальной аконитазы до значительного уровня, изменяя метаболизм аминокислот и гомеостаз клеточного железа. (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Марганец всасывается главным образом при приеме внутрь, но также может поступать при вдыхании. Он связывается с альфа-2-макроглобулином, альбумином или трансферрином в плазме и распределяется в головном мозге и всех других тканях млекопитающих, хотя имеет тенденцию накапливаться больше в печени, поджелудочной железе и почках. Марганец может существовать в нескольких степенях окисления и, как полагают, претерпевает изменения степени окисления в организме. Степень окисления марганца может влиять на токсикокинетическое поведение тканей и, возможно, на токсичность. Марганец выводится преимущественно с фекалиями. (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Значения токсичности | LD50: 305 мг/кг (перорально, мышь) (1) LD50: 64 мг/кг (внутрибрюшинно, мышь) (1) LD50: 146 мг/кг (подкожно, мышь) (1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Канцерогенность (Классификация IARC) | Нет указаний на канцерогенность для человека (не указано) от МАИР). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Использование/Источники | Сульфат марганца является предшественником металлического марганца и многих химических соединений, таких как диоксид марганца. (5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минимальный уровень риска | Хроническое вдыхание: 0,0003 мг/м3 (2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Влияние на здоровье | Манганец в основном влияет на нервную систему и может вызвать поведенческие изменения и другие эффекты нервной системы, которые включают перемещения, которые могут стать, которые могут стать, которые могут стать перемещениями, которые могут стать перемещениями. медленный и неуклюжий. Эта комбинация симптомов, когда она достаточно тяжелая, называется «манганизмом». (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Симптомы | Марганец в основном влияет на нервную систему и может вызывать изменения в поведении и другие эффекты нервной системы, включая движения, которые могут стать медленными и неуклюжими. Эта комбинация симптомов, когда она достаточно тяжелая, называется «манганизмом». (3) (3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лечение | ГЛАЗА: промывать открытые глаза в течение нескольких минут под проточной водой. ПРОГЛАТЫВАНИЕ: не вызывать рвоту. Прополоскать рот водой (никогда ничего не давать в рот человеку, находящемуся без сознания). Немедленно обратитесь за медицинской помощью. КОЖА: следует немедленно обработать путем промывания пораженных участков холодной проточной водой в течение не менее 15 минут с последующим тщательным мытьем водой с мылом. При необходимости человек должен принять душ и сменить загрязненную одежду и обувь, а затем обратиться за медицинской помощью. ВДЫХАНИЕ: приток свежего воздуха. При необходимости обеспечить искусственное дыхание. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нормальные концентрации | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аномальные концентрации | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Недоступно 9 0115 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ссылки | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор DrugBank | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор HMDB | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор соединения PubChem | 24580 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор CheMBL | CHEMBL2103742 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 22984 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| KEGG ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| UniProt ID | 9011 4 Нет в наличии|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| OMIM ID | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЧЭБИ ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CTD ID | C039798 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ID стежка | Сульфат марганца | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор PDB | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ID АКТОРА | 12206 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка на Википедию | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка на синтез | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
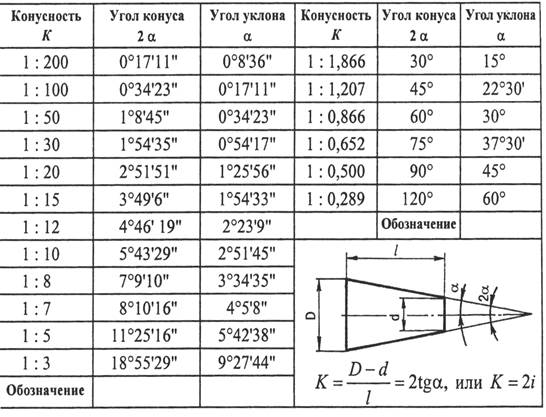
| MSDS | T3D1131. Угол 1 10 сколько градусов: Нормальные конусности и углыНормальные конусности и углыНормальные конусности и углыГлавконструктор 3D сканирование и ru en Источник: ГОСТ 8593-81 Конусность К есть отношение разности диаметров двух поперечных сечений конуса к расстоянию между ними. Уклон «i» есть отношение разности размеров двух поперечных сечений к расстоянию между ними. Таблица 1. Углы конусности
К оглавлению
Уклон и Конусность — Определение, обозначение на чертеже, формула расчёта уклона и конусности ChertimVam. Ru RuИногда, в задачах по начертательной геометрии или работах по инженерной графике, или при выполнении других чертежей, требуется построить уклон и конус. В этой статье Вы узнаете о том, что такое уклон и конусность, как их построить, как правильно обозначить на чертеже. Что такое уклон? Как определить уклон? Как построить уклон? Обозначение уклона на чертежах по ГОСТ.Уклон. Уклон это отклонение прямой линии от вертикального или горизонтального положения. Построение уклона. На примере (рисунок ) наглядно продемонстрировано построение уклона. Для построения уклона 1:1, например, нужно на сторонах прямого угла отложить произвольные, но равные отрезки. Такой уклон, будет соответствовать углу в 45 градусов. Обозначение уклона на чертежах. Обозначение уклонов на чертеже выполняется в соответствии с ГОСТ 2.307—68. На чертеже указывают величину уклона с помощью линии-выноски. На полке линии-выноски наносят знак и величину уклона. Знак уклона должен соответствовать уклону определяемой линии, то есть одна из прямых знака уклона должна быть горизонтальна, а другая должна быть наклонена в ту же сторону, что и определяемая линия уклона. Угол уклона линии знака примерно 30°. Что такое конусность? Формула для расчёта конусности. Обозначение конусности на чертежах.Конусность. Конусностью называется отношение диаметра основания конуса к высоте. Конусность рассчитывается по формуле К=D/h, где D – диаметр основания конуса, h – высота. Обозначение конусности на чертежах. Форму и величину конуса определяют нанесением трех из перечисленных размеров: 1) диаметр большого основания D; 2) диаметр малого основания d; 3) диаметр в заданном поперечном сечении Ds , имеющем заданное осевое положение Ls; 4) длина конуса L; 5) угол конуса а; 6) конусность с . Также на чертеже допускается указывать и дополнительные размеры, как справочные. Размеры стандартизованных конусов не нужно указывать на чертеже. Достаточно на чертеже привести условное обозначение конусности по соответствующему стандарту. Конусность, как и уклон, может быть указана в градусах, дробью (простой, в виде отношения двух чисел или десятичной), в процентах. Расчет уклона и общих уклонов в архитектуреАрхитекторы постоянно предоставляют информацию об уклоне на своих чертежах, используя градиенты, градусы или проценты в зависимости от приложения. Например, крыши отмечаются с помощью уклонов, а поперечные уклоны тротуаров обычно обозначаются в градусах. Полезно понять, как рассчитать каждый метод.
Существует три различных способа указания наклона поверхности относительно горизонтальной плоскости: градусы, градиент и проценты. Расчет градиента уклонаРасчет градиента уклонаГрадиенты уклона записываются в виде Y:X, где Y — единица подъема, а X — протяженность. Оба числа должны использовать одни и те же единицы измерения. Например, если вы путешествуете на 3 дюйма по вертикали и на 3 фута (36 дюймов) по горизонтали, уклон составит 3:36 или 1:12. Это читается как «один из двенадцати наклонов». Расчет процента уклонаРасчет процента уклонаПроцент уклона рассчитывается почти так же, как градиент. Переведите рост и пробег в одни и те же единицы, а затем разделите рост на пробег. Умножьте это число на 100, и вы получите процент наклона. Например, подъем 3 дюйма, разделенный на длину 36 дюймов = 0,083 x 100 = уклон 8,3%. Вычисление уклона в градусахВычисление уклона в градусах Самый сложный способ вычисления уклона — в градусах, и он требует немного математики средней школы. Тангенс данного угла (в градусах) равен подъему, деленному на пробег. Таблица общих уклонов в архитектуреВ таблице ниже показаны некоторые распространенные уклоны. Полы с уклоном 1:20 не требуют поручней, но все, что круче 1:20, считается пандусом и требует наличия поручней. Пандусы с наклоном 1:12 — это максимальный уклон, разрешенный кодами ADA, и для них требуются поручни. Федеральные коды ADA указывают, что максимальный поперечный уклон доступного маршрута составляет 1:48, что составляет чуть более 2%. Однако мы видели некоторые юрисдикции, которые допускают максимальный поперечный уклон 1:50. В следующей таблице представлены распространенные уклоны по уклону (градусы и проценты рассчитаны):
Далее у нас есть некоторые общие наклоны в градусах (градиент и процент вычисляются): 057 1° | 1 : 57,29 | 1,75% | 5° | 1 : 11,43 | 8,75% | 10° | 1 : 5,67 | 17,63% | 15° | 1 : 3,73 | 26,79% | 30° | 1 : 1,73 | 57,74% | 45° | 1 : 1 | 10 0% | 60° | 1 : 0,58 | 173,21% | 90° | 1 : 0 | инф. | 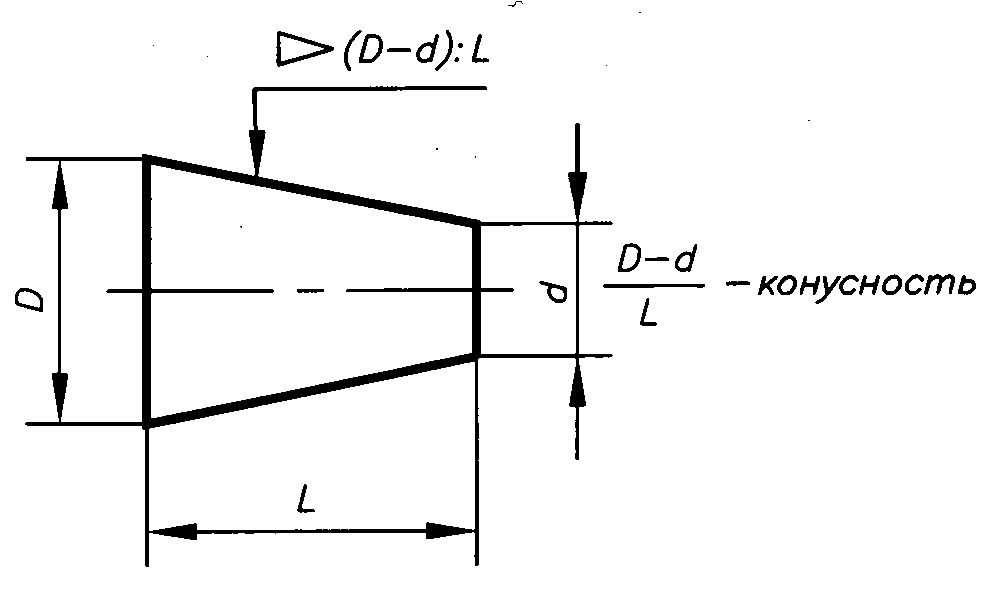 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Наконец, вот список некоторых распространенных наклонов в процентах (градусы и градусы рассчитываются):0055
Уклоны крыши
Уклоны крыши идентифицируются с использованием описанного выше градиентного метода, где подъем варьируется, но уклон обычно равен 12. На некоторых очень крутых крышах вы можете увидеть инвертированный уклон, так что уклон меняется, но подъем сохраняется равным 12.
На некоторых очень крутых крышах вы можете увидеть инвертированный уклон, так что уклон меняется, но подъем сохраняется равным 12.
Крыши с малым уклоном
Крыши с малым уклоном имеют уклон 3:12 или меньше. Они должны иметь мембранную систему крыши для обеспечения водонепроницаемости.
| НАКЛОН КРЫШИ | ГРАДУСЫ | ПРОЦЕНТЫ |
|---|---|---|
| 1/4 : 12 | 9 0059 1,19°2,08% | |
| 1/2 : 12 | 2,39° | 4,17% |
| 1 : 12 | 4,76° | 8,3% |
| 2 : 12 | 9,46° | 16,67% |
| 3 : 12 | 14,04° | 25% |
Крыши с крутым уклоном
Все, что выше 3:12, считается крутой крышей и может быть покрыто с металлическими панелями, черепицей или черепицей — эти крыши не пропускают воду и не считаются водонепроницаемыми.
| НАКЛОН КРЫШИ | ГРАДУСЫ | ПРОЦЕНТЫ |
|---|---|---|
| 4 : 12 | 900 59 18,43°33,33% | |
| 5 : 12 | 22,62° | 41,67% |
| 6 : 12 900 60 | 26,57° | 50% |
| 7 : 12 | 30,26° | 58,33% |
| 8 : 12 | 33,69° | 66,67% |
| 9 : 12 | 36,87° | 90 059 75%|
| 10 : 12 | 39,81° | 83,33% |
| 11 : 12 | 42,51° | 91,67% |
| 12 : 12 | 45° | 100% |
 На самом деле крыша может быть почти вертикальной.
На самом деле крыша может быть почти вертикальной.Уклоны водопроводных труб
Как обсуждалось в нашей статье об уклонах труб, уклоны дренажных и канализационных труб, как правило, минимальны. Идея состоит в том, чтобы поддерживать поток воды и твердых частиц. Используются три общих уклона, на которые ссылаются в Международном сантехническом кодексе. 91 /4″ на фут
Статья обновлена: 29 ноября 2022 г.
Помогите сделать Archtoolbox лучше для всех. Если вы обнаружили ошибку или устаревшую информацию в этой статье (даже если это всего лишь незначительная опечатка), сообщите нам об этом.
Если вы обнаружили ошибку или устаревшую информацию в этой статье (даже если это всего лишь незначительная опечатка), сообщите нам об этом.
Полезные инструменты для архитекторов и проектировщиков зданий
Калькулятор центрального угла. Найдите длину дуги, радиус, центральный угол
Автор: Jasmine J Mah0003 Содержание:
- Что такое центральный угол?
- Откуда берется формула центрального угла?
- Калькулятор угла окружности в пересчете на пиццу
- Сколько кусочков пиццы с центральным углом в 1 радиан можно отрезать от круглой пиццы?
- Бонусное задание – Как далеко Земля перемещается в каждое время года?
- Часто задаваемые вопросы
Вы когда-нибудь задумывались, как найти центральный угол окружности? Калькулятор центрального угла здесь, чтобы помочь; единственные переменные, которые вам нужны, это длина дуги и радиус.
Читайте дальше, чтобы узнать определение центрального угла и как использовать формулу центрального угла.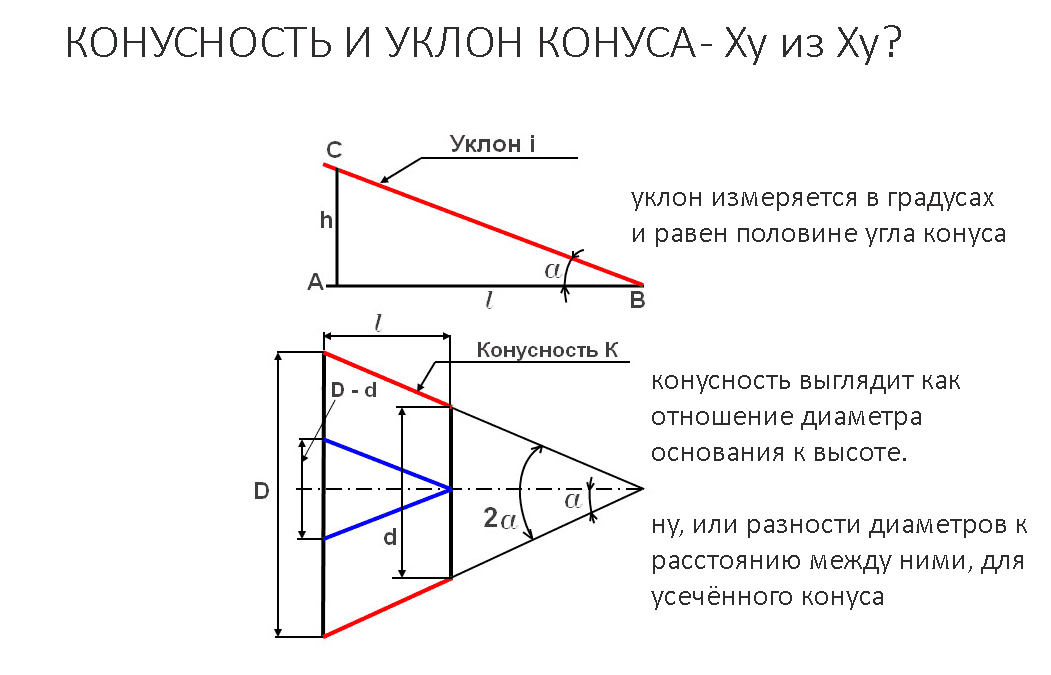
Что такое центральный угол?
Центральный угол — это угол с вершиной в центре круга, стороны которого выходят на окружность. Вы можете представить, что центральный угол находится на кончике куска пиццы в большой круглой пицце.
Центральный угол окружности можно найти по формуле:
θ = L / r
, где θ — центральный угол в радианах, L — длина дуги, а r — радиус.
Откуда берется формула центрального угла?
Простота формулы центрального угла проистекает из определения радиана. радиан — это единица углового размера, где 1 радиан определяется как центральный угол ( θ ), длина дуги которого равна радиусу ( L = r ).
Калькулятор угла окружности в терминах пиццы
Поскольку математика может сделать людей голодными, мы могли бы лучше понять центральный угол в терминах пиццы. Хотите верьте, хотите нет, но пицца отлично подходит для объяснения математики круга, как вы можете видеть на нашем калькуляторе размера пиццы Каким был бы центральный угол для куска пиццы, если длина корки (LLL) была равна радиусу ( ррр)?
Поскольку задача определяет L=rL = rL=r, и мы знаем, что 111 радиан определяется как центральный угол, когда L=rL = rL=r, мы можем видеть, что центральный угол равен 111 радианам.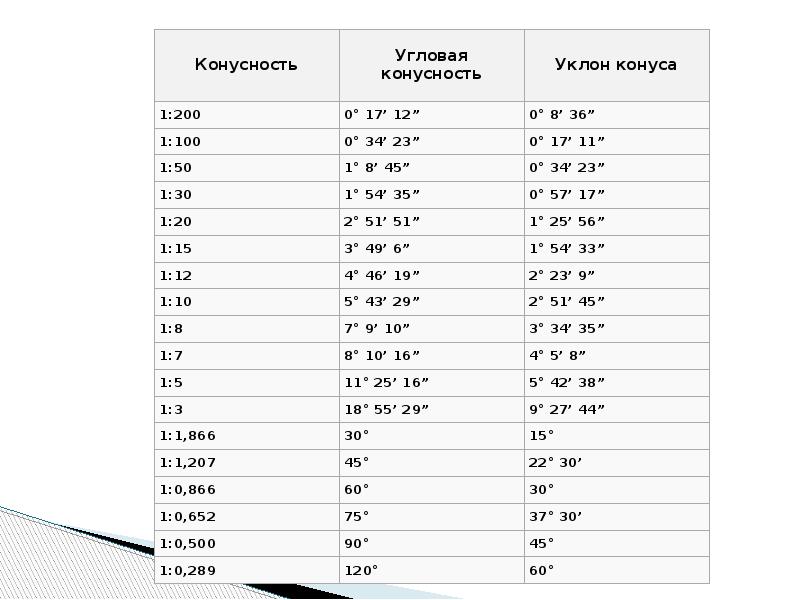 Мы также могли бы использовать формулу центрального угла следующим образом:
Мы также могли бы использовать формулу центрального угла следующим образом:
θ=Lr=LL=1 рад\begin{split} \theta&=\frac{L}{r}\\[1em] &=\frac{L}{L}\\[1em] &=1\ \mathrm{рад} \end{split}θ=rL=LL=1 рад
Сколько кусочков пиццы с центральным углом в 1 радиан вы могли бы отрезать от круглой пиццы?
Мы знаем, что в полной круглой пицце центральные углы всех ломтиков в сумме составляют 2π радиан = 360°. Поскольку каждый срез имеет центральный угол 111 радиан, нам потребуется 2π/1=2π2\pi / 1 = 2\pi2π/1=2π срезов или 6 286 286,28 срезов, чтобы заполнить полный круг.
Мы приходим к тому же ответу, если рассматривать эту задачу в терминах корочки для пиццы: мы вычисляем длину окружности 2πr2\pi r2πr. Так как длина корочки = радиус, то по периметру пиццы поместится 2πr/r=2π2\pi r / r = 2\pi2πr/r=2π корок.
Теперь, если вы все еще голодны, взгляните на калькулятор площади сектора, чтобы рассчитать площадь каждого кусочка пиццы!
Бонусное задание – Как далеко Земля перемещается в каждое время года?
Попробуйте использовать калькулятор центрального угла в обратном порядке, чтобы решить эту проблему. Земля примерно 1490,6 млн км от Солнца. Если Земля проходит около четверти своей орбиты каждый сезон, сколько километров Земля проходит каждый сезон (например, с весны до лета)?
Земля примерно 1490,6 млн км от Солнца. Если Земля проходит около четверти своей орбиты каждый сезон, сколько километров Земля проходит каждый сезон (например, с весны до лета)?
Давайте подойдем к этой проблеме шаг за шагом:
Упростите задачу, предположив, что орбита Земли круговая ( Орбита Земли на самом деле эллиптическая и постоянно меняется ). В этой модели Солнце находится в центре круга, а орбита Земли — это окружность.
Радиус — это расстояние от Земли и Солнца: 149,6149,6149,6 млн км.
Центральный угол равен четверти окружности: 360°/4=90°360\градус / 4 = 90\градус360°/4=90°.
Используйте калькулятор центрального угла, чтобы найти длину дуги .
Вы можете сами попробовать произвести окончательный расчет, изменив формулу следующим образом:
L=θ⋅rL = \theta \cdot rL=θ⋅r 96\ \mathrm{км} \end{split}L=1,57⋅149,6×106 км=234,9×106 км
Если предположить, что по идеально круговой орбите Земля проходит примерно 234,9 млн км каждый сезон!
Часто задаваемые вопросы
Как найти центральный угол окружности?
Чтобы найти центральный угол окружности, используйте формулу:
θ = L / r
где:
-
θ— центральный угол в радианах; -
L— Длина дуги; и -
r— Радиус окружности.


 Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O.
Здесь в реагентах и продуктах присутствуют Mn, H, Cl, S и O. Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
Используя стехиометрические коэффициенты, мы можем приравнять количество элементов с обеих сторон. Уравнение дано,
 0115
0115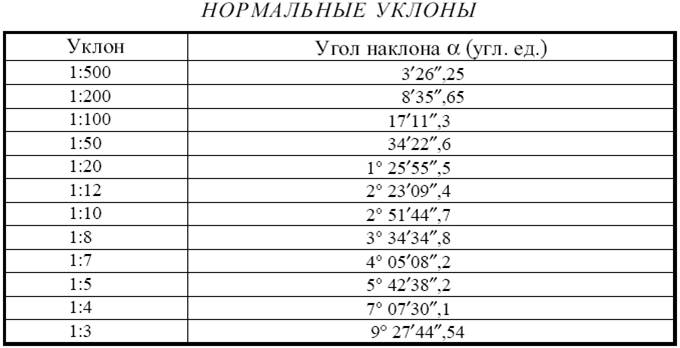 Для того чтобы построить уклон 1:2, нужно по горизонтали отложить отрезок равный по значению двум отрезкам отложенным по вертикали. Как видно из чертежа, уклон есть отношение катета противолежащего к катету прилежащему, т. е. он выражается тангенсом угла а.
Для того чтобы построить уклон 1:2, нужно по горизонтали отложить отрезок равный по значению двум отрезкам отложенным по вертикали. Как видно из чертежа, уклон есть отношение катета противолежащего к катету прилежащему, т. е. он выражается тангенсом угла а. Если конус усеченный, то конусность рассчитывается как отношение разности диаметров усеченного конуса к его высоте. В случае усечённого конуса, формула конусности будет иметь вид: К = (D-d)/h.
Если конус усеченный, то конусность рассчитывается как отношение разности диаметров усеченного конуса к его высоте. В случае усечённого конуса, формула конусности будет иметь вид: К = (D-d)/h.

 Следовательно, арктангенс подъема, деленный на разбег, даст угол.
Следовательно, арктангенс подъема, деленный на разбег, даст угол.
 В нумерологии число 49 означает цифру 4.
В нумерологии число 49 означает цифру 4.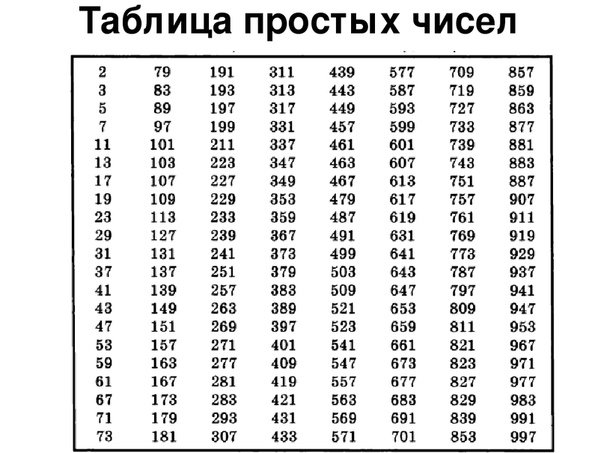 Оно записывается 2 цифрами.
Сумма цифр, из которых состоит число 49, равна 13, а их произведение равно 36.
Число 49 является нечетным.
Всего число 49 имеет 3 делителей:
1,
7,
49,
. Сумма делителей равна 57. Куб числа 49 равен 2401, а квадрат составляет 117649.
Квадратный корень рассматриваемого числа равен 7. Кубический корень равен 3,65930571002297.
Число, которое является обратным к числу 49, выглядит как 0,0204081632653061.
Оно записывается 2 цифрами.
Сумма цифр, из которых состоит число 49, равна 13, а их произведение равно 36.
Число 49 является нечетным.
Всего число 49 имеет 3 делителей:
1,
7,
49,
. Сумма делителей равна 57. Куб числа 49 равен 2401, а квадрат составляет 117649.
Квадратный корень рассматриваемого числа равен 7. Кубический корень равен 3,65930571002297.
Число, которое является обратным к числу 49, выглядит как 0,0204081632653061.
 Число 49 делится на 1, 7, 49. Чтобы число считалось простым, оно должно иметь ровно два делителя. С 49 годаимеет более двух делителей, то есть 1, 7, 49, это не простое число.
Число 49 делится на 1, 7, 49. Чтобы число считалось простым, оно должно иметь ровно два делителя. С 49 годаимеет более двух делителей, то есть 1, 7, 49, это не простое число. 659301
659301 Он имеет в общей сложности 3 множителя, из которых 49 является самым большим множителем, а положительные множители числа 49 равны 1, 7 и 49. Сумма всех множителей числа 49 равна 57. Его простые множители равны 1, 7, 49 и ( 1, 49) и (7, 7) — парные множители.
Он имеет в общей сложности 3 множителя, из которых 49 является самым большим множителем, а положительные множители числа 49 равны 1, 7 и 49. Сумма всех множителей числа 49 равна 57. Его простые множители равны 1, 7, 49 и ( 1, 49) и (7, 7) — парные множители.


 Испытайте Cuemath и приступайте к работе.
Испытайте Cuemath и приступайте к работе.
 Например, если – это сторона квадрата, тогда останется лишь один вариант .
Например, если – это сторона квадрата, тогда останется лишь один вариант .
 Условие однозначности не выполнено. Чтобы сделать эту функцию обратимой, нужно добавить дополнительные условия. Так, если мы рассмотрим функцию только для положительных , то каждому значению будет уже соответствовать только одно значение (см. рис. 9).
Условие однозначности не выполнено. Чтобы сделать эту функцию обратимой, нужно добавить дополнительные условия. Так, если мы рассмотрим функцию только для положительных , то каждому значению будет уже соответствовать только одно значение (см. рис. 9). А когда мы говорим о расширенном понятии угла, как раз и появляется многозначность.
А когда мы говорим о расширенном понятии угла, как раз и появляется многозначность.
 Косинус – это абсцисса точки на единичной окружности. Видим две точки, абсциссы которых равны – точки и (см. рис. 12).
Косинус – это абсцисса точки на единичной окружности. Видим две точки, абсциссы которых равны – точки и (см. рис. 12). Посмотрим, что же будет в обратном случае.
Посмотрим, что же будет в обратном случае. То есть значение арккосинуса мы определяем как величину угла. Из геометрии мы знаем, что длина дуги определяется как , где – величина центрального угла, на который опирается дуга, – радиус (см. рис. 16).
То есть значение арккосинуса мы определяем как величину угла. Из геометрии мы знаем, что длина дуги определяется как , где – величина центрального угла, на который опирается дуга, – радиус (см. рис. 16). А значения арккосинуса связаны с , величина которого изменяется от (крайнее правое положение) до (крайнее левое положение).
А значения арккосинуса связаны с , величина которого изменяется от (крайнее правое положение) до (крайнее левое положение). Таким образом, на отрезке определена обратимая функция .
Таким образом, на отрезке определена обратимая функция .
 Иллюстрация к примеру 3
Иллюстрация к примеру 3 Получим:
Получим: График функции
График функции Абсциссу этой точки обозначим как .Тогда с учетом периодичности тангенса абсциссы всех остальных точек можно представить в виде (см. рис. 28):
Абсциссу этой точки обозначим как .Тогда с учетом периодичности тангенса абсциссы всех остальных точек можно представить в виде (см. рис. 28): рис. 29).
рис. 29). График функции получается из графика функции , симметрией относительно прямой (см. рис. 31).
График функции получается из графика функции , симметрией относительно прямой (см. рис. 31). Теперь наша задача – вычислить . По определению арккосинуса:
Теперь наша задача – вычислить . По определению арккосинуса: Но он будет неправильным, поскольку . Значения тангенса будут равны в тех случаях, когда их аргументы отличаются на периоды: . Осталось подобрать такое целое значение , для которого . Для этого решим неравенство:
Но он будет неправильным, поскольку . Значения тангенса будут равны в тех случаях, когда их аргументы отличаются на периоды: . Осталось подобрать такое целое значение , для которого . Для этого решим неравенство:  ru
ru

 Для решения однородного уравнения, поступают следующим образом:
Для решения однородного уравнения, поступают следующим образом:



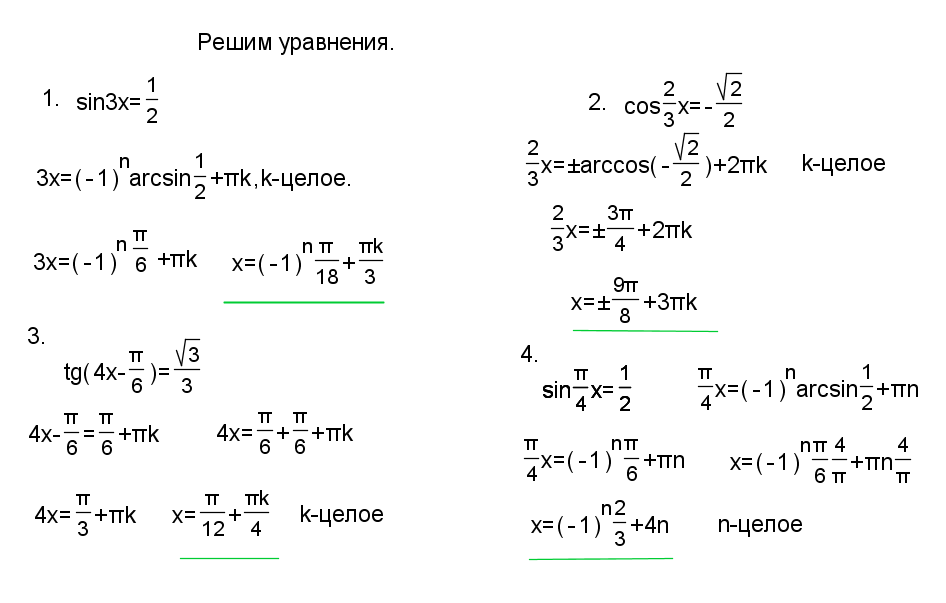
 1: Решение тригонометрических уравнений с тождествами
1: Решение тригонометрических уравнений с тождествами



 231, \quad\pi , 5.052\nonumber\]
231, \quad\pi , 5.052\nonumber\]
 Одновременно с этим извещатель осуществляет механическую фиксацию управляющей кнопки в нажатом состоянии.
Одновременно с этим извещатель осуществляет механическую фиксацию управляющей кнопки в нажатом состоянии. За подробной информацией о комплектации интересующего вас товара обращайтесь к менеджерам. Тел. +7(351)7000370
За подробной информацией о комплектации интересующего вас товара обращайтесь к менеджерам. Тел. +7(351)7000370 001 … 1.0
001 … 1.0
 )
) 1.2
1.2 1.2
1.2 1.2 Назад
1.2 Назад )
) 1.2 KNF США
1.2 KNF США
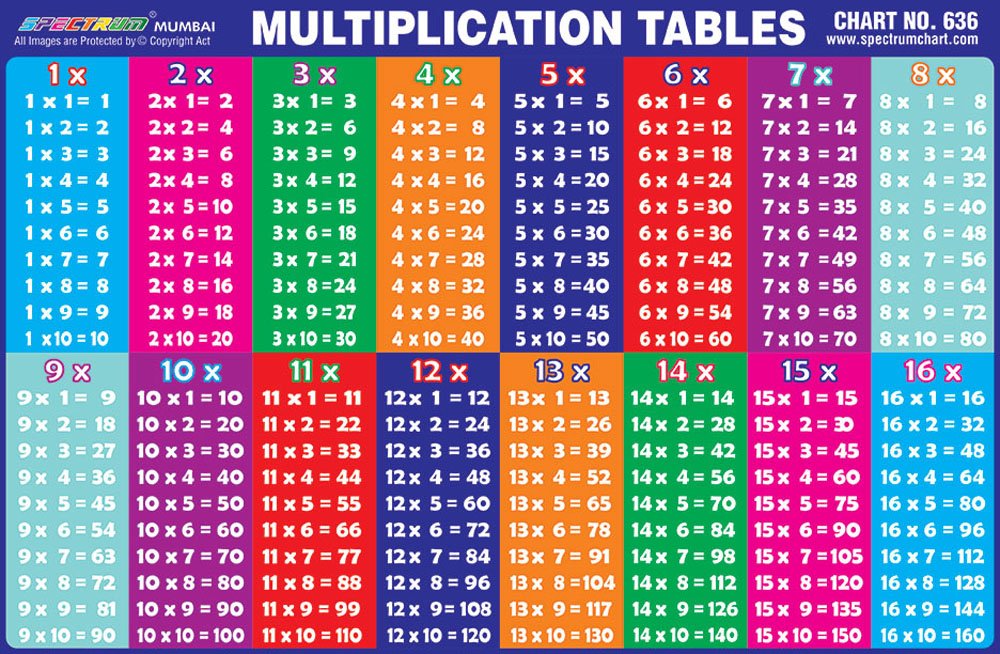 Сколько деталей изготовят оба рабочих за 2 дня?
Сколько деталей изготовят оба рабочих за 2 дня? Таблица умножения — достаточно большой объём информации, который самостоятельно может освоить не каждый ребёнок. Поэтому мы собрали несколько советов, которые облегчат жизнь родителям и детям.
Таблица умножения — достаточно большой объём информации, который самостоятельно может освоить не каждый ребёнок. Поэтому мы собрали несколько советов, которые облегчат жизнь родителям и детям.
 Усложнённая версия — доставать кости одновременно и на скорость перемножать числа.
Усложнённая версия — доставать кости одновременно и на скорость перемножать числа.

 02+17.19
02+17.19
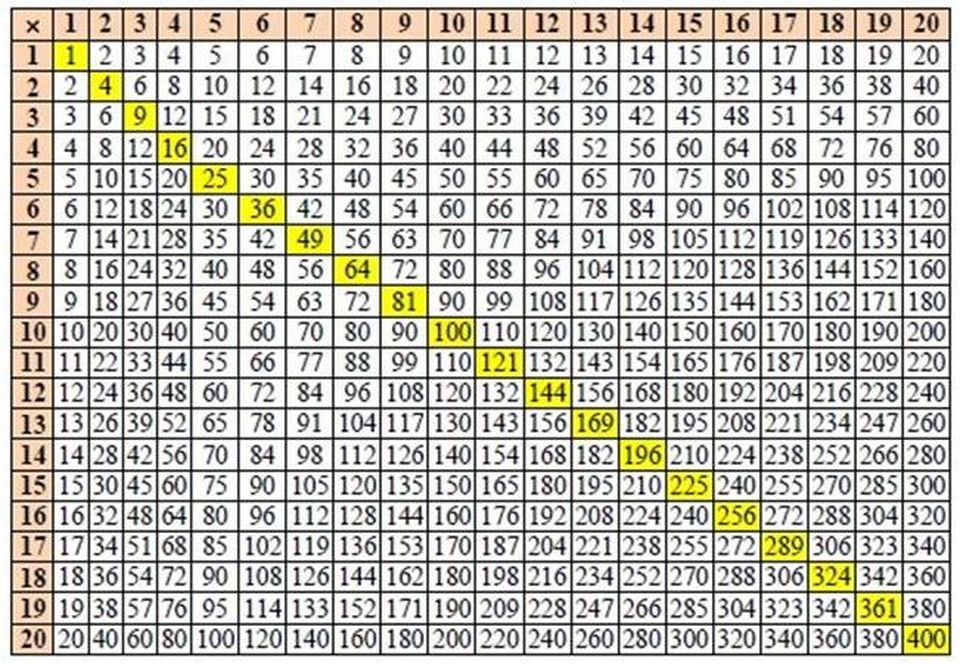


 Найдите: а)наименьшее значение функции; б) значения x, при которых значение функции равно 5; в) значение…
Найдите: а)наименьшее значение функции; б) значения x, при которых значение функции равно 5; в) значение…

 Для закрепления результатов советуем возвращаться на сайт «Школково» ежедневно.
Для закрепления результатов советуем возвращаться на сайт «Школково» ежедневно. В первом примере мы сделаем проверку. В последующих проверку сделайте самостоятельно.
В первом примере мы сделаем проверку. В последующих проверку сделайте самостоятельно.

 Если уравнение имеет более одного корня, в ответе укажите меньший из них.
Если уравнение имеет более одного корня, в ответе укажите меньший из них.


 Здесь достаточно знать свойства логарифмов для его решения. Но такая удача случается не часто, поэтому приготовьтесь к более сложным вещам.
Здесь достаточно знать свойства логарифмов для его решения. Но такая удача случается не часто, поэтому приготовьтесь к более сложным вещам. е. без каких бы то ни было коэффициентов и других разного рода выражений.
е. без каких бы то ни было коэффициентов и других разного рода выражений. е. (4х-1), получаем:
е. (4х-1), получаем: Первая – это само решение уравнения, вторая — работа с областью допустимых значений (ОДЗ). Вот как раз первую часть мы и освоили. В вышеприведенных примерах ОДЗ на ответ никак не влияет, поэтому мы ее и не рассматривали.
Первая – это само решение уравнения, вторая — работа с областью допустимых значений (ОДЗ). Вот как раз первую часть мы и освоили. В вышеприведенных примерах ОДЗ на ответ никак не влияет, поэтому мы ее и не рассматривали.
 А вот уж после этого можно делать с нашим уравнением все, что душа пожелает. Получив ответ, мы просто выбрасываем те корни, которые не входят в нашу ОДЗ, и записываем окончательный вариант.
А вот уж после этого можно делать с нашим уравнением все, что душа пожелает. Получив ответ, мы просто выбрасываем те корни, которые не входят в нашу ОДЗ, и записываем окончательный вариант. е. мы еще ничего не решали, но уже записали обязательное условие на всё подлогарифменное выражение. Фигурная скобка означает, что эти условия должны выполняться одновременно.
е. мы еще ничего не решали, но уже записали обязательное условие на всё подлогарифменное выражение. Фигурная скобка означает, что эти условия должны выполняться одновременно. уравнений и отработка метода интервалов на практике.
уравнений и отработка метода интервалов на практике. Теперь подставьте по аналогии числа, и поймете окончательно, как решаются логарифмы. Теперь осталось лишь совместить два рассмотренных понятия. Изначально ситуация кажется чрезвычайно сложной, но при ближайшем рассмотрении весе становится на свои места. Мы уверены, что после этой короткой статьи у вас не будет проблем в этой части ЕГЭ.
Теперь подставьте по аналогии числа, и поймете окончательно, как решаются логарифмы. Теперь осталось лишь совместить два рассмотренных понятия. Изначально ситуация кажется чрезвычайно сложной, но при ближайшем рассмотрении весе становится на свои места. Мы уверены, что после этой короткой статьи у вас не будет проблем в этой части ЕГЭ. В результате приходится мириться с ошибками и не получать желаемых баллов. Самой обидной ошибкой будет, если вы перепутаете буквы местами. Чтобы решить уравнение этим способом, нужно зазубрить эту стандартную школьную формулу, потому что понять ее сложно.
В результате приходится мириться с ошибками и не получать желаемых баллов. Самой обидной ошибкой будет, если вы перепутаете буквы местами. Чтобы решить уравнение этим способом, нужно зазубрить эту стандартную школьную формулу, потому что понять ее сложно. Сводится правило к тому, что F(x) обязательно больше 0. Нет, мы не упустили этот момент. Сейчас мы говорим об еще одном серьезном преимуществе канонической формы.
Сводится правило к тому, что F(x) обязательно больше 0. Нет, мы не упустили этот момент. Сейчас мы говорим об еще одном серьезном преимуществе канонической формы.
 Примеры решения логарифмического уравнения достаточно просты, не так ли? Теперь и у вас получится самостоятельно разобраться даже с самыми сложными задачами для подготовки и сдачи ЕГЭ.
Примеры решения логарифмического уравнения достаточно просты, не так ли? Теперь и у вас получится самостоятельно разобраться даже с самыми сложными задачами для подготовки и сдачи ЕГЭ. Готовьтесь к экзаменам заблаговременно, и удачи вам!
Готовьтесь к экзаменам заблаговременно, и удачи вам! Чаще всего в школе учат решать логарифмическое уравнение с помощью определения логарифма. То есть мы имеем уравнение вида:Вспоминаем определение логарифма и получаем следующее:Таким образом мы получаем простое уравнение, которое сможем легко решить.
Чаще всего в школе учат решать логарифмическое уравнение с помощью определения логарифма. То есть мы имеем уравнение вида:Вспоминаем определение логарифма и получаем следующее:Таким образом мы получаем простое уравнение, которое сможем легко решить. То есть при преобразовании logaf(x) = b, многие возводят не a в степень b, а наоборот b в степень a. Такая досадная ошибка может лишить вас драгоценных баллов на ЕГЭ.
То есть при преобразовании logaf(x) = b, многие возводят не a в степень b, а наоборот b в степень a. Такая досадная ошибка может лишить вас драгоценных баллов на ЕГЭ. Для этого вспоминаем еще одно свойство логарифма:
Для этого вспоминаем еще одно свойство логарифма: Следовательно, х = 3 является корнем уравнения.
Следовательно, х = 3 является корнем уравнения. А что же делать, если основания у логарифмов разные? Например,
А что же делать, если основания у логарифмов разные? Например, е. определенным значением – 2, 3, ½ … Но в основании логарифма может содержаться Х, тогда такое основание будет называться переменным. Например, logx+1(х2+5х-5) = 2. Мы видим, что основание логарифма в данном уравнении – х+1. Как же решать уравнение такого вида? Решать мы его будем по тому же принципу, что и предыдущие. Т.е. мы будем преобразовывать наше уравнение таким образом, чтобы слева и справа были логарифмы с одинаковым основанием.Преобразуем правую часть уравнения:Теперь логарифм в правой части уравнения имеет такое же основание, как и логарифм в левой части:Теперь мы можем зачеркнуть логарифмы:Но данное уравнение неравносильно исходному уравнению, так как не учтена область определения. Запишем все требования, относящиеся к логарифму:
е. определенным значением – 2, 3, ½ … Но в основании логарифма может содержаться Х, тогда такое основание будет называться переменным. Например, logx+1(х2+5х-5) = 2. Мы видим, что основание логарифма в данном уравнении – х+1. Как же решать уравнение такого вида? Решать мы его будем по тому же принципу, что и предыдущие. Т.е. мы будем преобразовывать наше уравнение таким образом, чтобы слева и справа были логарифмы с одинаковым основанием.Преобразуем правую часть уравнения:Теперь логарифм в правой части уравнения имеет такое же основание, как и логарифм в левой части:Теперь мы можем зачеркнуть логарифмы:Но данное уравнение неравносильно исходному уравнению, так как не учтена область определения. Запишем все требования, относящиеся к логарифму: Смотрите х2+5х-5 больше ноля, при этом оно приравнивается к (х + 1)2, которую в свою очередь так же больше ноля. Следовательно, требование х2+5х-5 > 0 выполняется автоматически и мы можем его не решать. Тогда наша система будет сведена к следующему:Перепишем нашу систему:Следовательно, наша система примет следующий вид:Теперь решаем наше уравнение:Справа у нас квадрат суммы:Данный корень удовлетворяет наши требования, так как 2 больше -1 и не равно 0. Следовательно, х = 2 – корень нашего уравнения.
Смотрите х2+5х-5 больше ноля, при этом оно приравнивается к (х + 1)2, которую в свою очередь так же больше ноля. Следовательно, требование х2+5х-5 > 0 выполняется автоматически и мы можем его не решать. Тогда наша система будет сведена к следующему:Перепишем нашу систему:Следовательно, наша система примет следующий вид:Теперь решаем наше уравнение:Справа у нас квадрат суммы:Данный корень удовлетворяет наши требования, так как 2 больше -1 и не равно 0. Следовательно, х = 2 – корень нашего уравнения. е. больше ноля.
е. больше ноля. Мы можем использовать этот факт вместе с правилами логарифмирования для решения логарифмических уравнений, где аргументом является алгебраическое выражение.
Мы можем использовать этот факт вместе с правилами логарифмирования для решения логарифмических уравнений, где аргументом является алгебраическое выражение.
 Для проверки можем подставить x = 9 в исходное уравнение: log 2 (9 – 1) = log 2 (8) = 3. Другими словами, когда логарифмическое уравнение имеет одинаковое основание с каждой стороны, аргументы должны быть равный. Это также применимо, когда аргументы являются алгебраическими выражениями. Поэтому, когда у нас есть уравнение с логарифмами одинакового основания на каждой стороне, мы можем использовать правила логарифмирования, чтобы переписать каждую сторону как один логарифм. Затем мы используем тот факт, что логарифмические функции являются взаимно однозначными, чтобы установить аргументы равными друг другу и найти неизвестное.
Для проверки можем подставить x = 9 в исходное уравнение: log 2 (9 – 1) = log 2 (8) = 3. Другими словами, когда логарифмическое уравнение имеет одинаковое основание с каждой стороны, аргументы должны быть равный. Это также применимо, когда аргументы являются алгебраическими выражениями. Поэтому, когда у нас есть уравнение с логарифмами одинакового основания на каждой стороне, мы можем использовать правила логарифмирования, чтобы переписать каждую сторону как один логарифм. Затем мы используем тот факт, что логарифмические функции являются взаимно однозначными, чтобы установить аргументы равными друг другу и найти неизвестное.

 0.
0. Вы можете построить график функции Ln ( x )-8 и посмотреть, где она пересекает ось x. Если вы правы, график должен пересечь ось X в ответе, который вы получили алгебраически.
Вы можете построить график функции Ln ( x )-8 и посмотреть, где она пересекает ось x. Если вы правы, график должен пересечь ось X в ответе, который вы получили алгебраически.  Уравнение
Уравнение Если мы потребуем, чтобы x был любым действительным числом, большим 3, все три термина будут действительными. Если все три условия верны, то уравнение верно.
Если мы потребуем, чтобы x был любым действительным числом, большим 3, все три термина будут действительными. Если все три условия верны, то уравнение верно. Если . Если
. x = 9 — наше единственное решение. Почему 9 единственное решение? Мы определили нашу область определения как все действительные числа больше 3.
Если . Если
. x = 9 — наше единственное решение. Почему 9 единственное решение? Мы определили нашу область определения как все действительные числа больше 3.
 {2}} \neq 1
для любого x \in [-1;1]
.
{2}} \neq 1
для любого x \in [-1;1]
.












 Это означает, что оно не четное и не нечетное.
Это означает, что оно не четное и не нечетное. 3 + 1 не является ни одной из функций. 92 – 3 $$
3 + 1 не является ни одной из функций. 92 – 3 $$ 
 список.
список.


 Пружины вертикальны. Верхний конец пружины жёсткостью 3k и нижний конец пружины жёсткостью k закреплены. Известно, что нижняя пружина сжата на a=5 см. Ускорение свободного падения g=10 Н/кг.
Пружины вертикальны. Верхний конец пружины жёсткостью 3k и нижний конец пружины жёсткостью k закреплены. Известно, что нижняя пружина сжата на a=5 см. Ускорение свободного падения g=10 Н/кг. ВОКАЛЬНЫЕ ЖАНРЫ:
ВОКАЛЬНЫЕ ЖАНРЫ: 6 класс. Учебник для учащихся общеобразовательных организаций / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир. Вентана-Граф. 2014г.2019г.ВыбранВыбрать
ГДЗ (готовое домашние задание из решебника) на Номер №183 по учебнику Математика. 6 класс. Учебник / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир, под редакцией В.Е. Подольского. Вентана-Граф. 4 издание, дополненное. 2019г.
6 класс. Учебник для учащихся общеобразовательных организаций / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир. Вентана-Граф. 2014г.2019г.ВыбранВыбрать
ГДЗ (готовое домашние задание из решебника) на Номер №183 по учебнику Математика. 6 класс. Учебник / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир, под редакцией В.Е. Подольского. Вентана-Граф. 4 издание, дополненное. 2019г. Какую часть всех шаров составляют синие? 2) В коробке лежит 14 шаров, из которых 3/7 составляют шары красного цвета. Сколько красных шаров в коробке? 3) В коробке лежат шары, 6 из которых белого цвета. Сколько всего шаров в коробке, если белые составляют 3/7 всех шаров?
Какую часть всех шаров составляют синие? 2) В коробке лежит 14 шаров, из которых 3/7 составляют шары красного цвета. Сколько красных шаров в коробке? 3) В коробке лежат шары, 6 из которых белого цвета. Сколько всего шаров в коробке, если белые составляют 3/7 всех шаров? И. Зубарева, А.Г. Мордкович. 2014-2019г.
И. Зубарева, А.Г. Мордкович. 2014-2019г. Найдите вероятность того, что вытащите синий или красный шар.
Найдите вероятность того, что вытащите синий или красный шар. Какова вероятность того, что случайно выбранный шар окажется синим или красным?
Какова вероятность того, что случайно выбранный шар окажется синим или красным? Мы 3 раза вытягивали один токен и снова возвращали его, записывая все возможности.
Мы 3 раза вытягивали один токен и снова возвращали его, записывая все возможности.
 2 Вопрос 4
2 Вопрос 4